| Titel: | Ueber eine zwekmäßige Behandlung des Marsh'schen Apparates bei Arsenikproben und den Einfluß des Schwefels auf das Erscheinen der Arsenikfleken; von Hrn. Blancard. |
| Fundstelle: | Band 82, Jahrgang 1841, Nr. XCV., S. 425 |
| Download: | XML |
XCV.
Ueber eine zwekmaͤßige Behandlung des
Marsh'schen Apparates
bei Arsenikproben und den Einfluß des Schwefels auf das Erscheinen der Arsenikfleken;
von Hrn. Blancard.
Aus dem Journal de Pharmacie, Sept. 1841, S.
543.
Mit Abbildungen auf Tab.
VI.
Blancard, über die Behandlung des Marsh'schen Apparates
etc.
In der Ueberzeugung, daß die Chemiker, wenn sie sich des Marsh'schen Apparates bedienen, nur dadurch oft zu widersprechenden
Resultaten gelangen, daß sie unter verschiedenen Umständen arbeiten, beschäftigte
ich mich damit, diesem Apparat eine solche Einrichtung zu geben, daß ich die mir am
günstigsten scheinenden Umstände nach Belieben hervorrufen konnte. Ich war unter
Beihülfe des Hrn. Véron
schon zu ziemlich befriedigenden Resultaten gelangt, als die Commission der Académie des sciences ihre Arbeit bekannt
machte.Polytechn. Journal Bd. LXXXI. S.
281. Der gelehrte Berichterstatter gibt, nachdem er sich über das Vertrauen
ausgesprochen hat, welches man den Fleken schenken darf, ein eben so einfaches als
genaues Mittel an, um die kleinsten Spuren von Arsenik entdeken zu können. Im
Bewußtseyn der geringeren Güte meines Apparats hätte ich denselben nicht bekannt
gemacht, wenn nicht ein kürzlich in der Academie de
Médecine entstandener Streit einige meiner Versuche, welche zu
erklären suchen, wie es kommt, daß Chemiker Arsenik gefunden haben, wo gar keiner
vorhanden war, zeitgemäß machen würde.
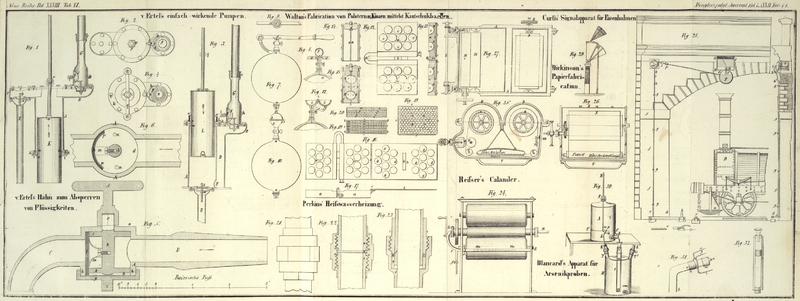
Mein Apparat besteht aus zwei Flaschen von 2 1/2 bis 3 Liter Rauminhalt, welche so
stehen, wie es Fig.
30 zeigt.
A Mariotte'sches Gefäß.
B Glasröhre, welche bis zum Niveau der Linie C, C reicht, die 4 Centimeter (1 1/2 franz. Zoll) über
dem Mittelpunkt des Hahns sich befindet.
F in dem Pfropf befestigte Nadel, zum Reguliren seines
Eindrükens.
C, C im Kreis gezogene Linie, durch welche man sich
überzeugen kann, daß der untere Theil der Röhre B immer
in gleicher Entfernung vom Mittelpunkt des Hahns ist.
E Hahn von Messing, dessen Schlüssel mit einem Zeiger
versehen ist, welcher sich an einem daran befestigten Kreisbogen bewegen kann.
H Flasche mit vier Tubulaturen, von Oben nach Unten in
Liter-Bruchtheile graduirt.
T weites Glasrohr, welches bis auf den Boden der Flasche
H hinabreicht.
K, K gläserne Hähne, deren untere Theile auf die
Tubulaturen T, T' gestekt sind.
L Glasröhre, oben in Millimeter eingetheilt und in der
Mitte in einen Winkel von beiläufig 100 Graden gebogen; ein Korkpfropf verbindet sie
mit dem Hahn K.
n, Fig. 31, Messingcylinder,
welcher sich an der Röhre L mit Reibung schieben
läßt.
x, y, z drei Schenkel von demselben Metall, welche am
Cylinder n befestigt sind und deren Spizen, wenn der
Cylinder an dem Null der Scala steht, sich in gleicher Linie mit der Oeffnung o befinden.
m Platinstük am Ende der Röhre L; es endigt sich in eine
Oeffnung o von 1 Millimeter Durchmesser.
Um meinen Apparat functioniren zu lassen, mußte eine Flüssigkeit ermittelt werden,
welche ohne merkliche Einwirkung auf das mit Wasserstoffgas verdünnte
Arsenikwasserstoffgas ist. Nach einigen vergleichenden Versuchen mit mehreren
Salzlösungen fiel meine Wahl auf eine concentrirte Kochsalzlösung, welche warm
bereitet, folglich von der Luft, die das Wasser gewöhnlich enthält, frei war.
Will man nun den Apparat in Gang sezen, so taucht man die mit Kochsalzlösung gefüllte
Flasche H in eine mit derselben Flüssigkeit gefüllte
Schüssel, öffnet die untere Tubulatur und bedient sich einer der oberen Tubulaturen,
um die Gase hineinzuleiten, die sich aus einer Phiole, welche die sie erzeugenden
Substanzen enthält, entwikeln. Hat man auf diese Art ein gewisses Volumen, z.B. ein
Liter, sich ansammeln lassen, so bringt man die Flasche H unter das Mariotte'sche Gefäß und öffnet dessen Hahn. Dieses Gefäß,
dessen Theorie hier zu wiederholen überflüssig wäre, gewährt ein constantes und
stets gleich bleibendes Ausfließen, bis das Niveau der Flüssigkeit, welche es
enthält, unterhalb der Linie C, C gesunken ist. Diese
Flüssigkeit, indem sie in die untere Flasche eintritt, nöthigt die darin
befindlichen Gase, durch die Oeffnung o mit einer
Regelmäßigkeit auszutreten, welche sich nothwendig auch der Flamme mittheilen muß.
Nur wenn sie wenig intensiv ist, ist diese in Folge der ihr stoßweise durch das
Niedersinken der Kochsalzlösung mitgetheilten Bewegung etwas unruhig. Diesem
Uebelstande half ich ab, indem ich in die weite Röhre eine andere von kleinerem
Durchmesser stekte, welche unten geschlossen und bei 4/5 ihrer Höhe mit einem Pfropf
versehen ist, welcher die beiden Räume trennt; siehe Fig. 32. Oben ist ein kleiner Trichter, und
zwar in der Art, angebracht, daß zwischen seiner Biegung und der kleinen Röhre genug
Raum bleibt, damit die Flüssigkeit frei abfließen kann. Durch diese Vorkehrung hebt
der Pfropf die Wirkung der Schwere auf; die Flüssigkeit steigt in der kleinen Röhre
wieder in die Höhe, darüber hinaus, und tritt in die Flasche durch die Wände der
beiden Röhren, in denen die Kraft der Capillarität verhindert, daß dieselben
Erscheinungen wieder eintreten.
Aus dem Vorausgehenden wird erhellen, daß die Intensität der Flamme der Quantität des
aus dem Apparate getriebenen Gases proportional seyn muß. Da diese nun durch das
Volumen der in die Flasche eintretenden Flüssigkeit repräsentirt ist, so konnte ich
mittelst der angebrachten Abtheilungen und einer guten Secundenuhr die
Geschwindigkeiten des Austritts von 1, 2, 4, 6 Centimetern Gas secundenweise
bestimmen und auf dem an dem Hahn angebrachten Kreisbogen anmerken; ferner konnte
ich, indem ich in die Gasometer-Flasche 2 Liter aus reinem Zink entwikelten
Wasserstoffs und 0,08 Centimeter Arsenikwasserstoff leitete, die relative
Empfindlichkeit von 4 Graden der Flamme bemessen, welche den oben angegebenen
Geschwindigkeiten des Austritts entsprechen, und es war die durch Verbrennung zweier
Centimeter Gas in der Secunde entstehende Flamme, welcher ich den Vorzug gab.
Bei diesem Apparat mit seiner regelmäßigen Flamme kann sich der Punkt der höchsten
Empfindlichkeit nicht verrüken. Ich fand, daß, um ihn jedesmal zu finden, ich den
kleinen Messingansaz (n) nur um 3,5 Millimeter vorwärts
zu schieben und die Porzellantasse an die Spizen der Schenkel x, y, z zu legen brauchte, welche leztere zugleich den Vortheil gewähren,
als Stüzpunkte zu dienen.
Der Durchmesser der Oeffnung, durch welche die Gase austreten, ist 1 Millimeter weit;
hätte man sich noch ferner des Marsh'schen Apparates zu
bedienenD.h. statt der von der Commission der französischen Akademie vorgeschlagenen
Verfahrungsarten.A. d. R., so hätte ich den Einfluß zu ermitteln gesucht, welchen eine Verschiedenheit
im Durchmesser dieser Oeffnung auf die Empfindlichkeit der Flamme haben kann.
Gegenwärtig aber wäre eine solche Untersuchung beinahe unnüz. Auch werde ich nur
einige meiner Versuche hier anführen.
In welchem Verhältnisse gegeneinander müssen sich die Gase befinden, damit sie
anfangen Fleken zu geben? Um diese Frage zu beantworten, bereite ich ein Normalgas
mit 1/100 Arsenikwasserstoffgehalt und lasse dann mittelst einer kleinen, in
Centimeter und 1/10 Centimeter abgetheilten Gloke, z.B. 0,08 Cent. in die Flasche H übertreten, welche vorher schon 2 Liter Wasserstoff
enthält. Gibt dieses Gemenge beim Versuche Fleken? Ich lasse ein bekanntes Volumen
davon austreten, erseze es durch ein gleiches Volumen Wasserstoffgas und wiederhole
diese Operation, bis der Apparat die Gegenwart des Arseniks nicht mehr anzeigt; nur
hüte ich mich kurz, ehe dieser Fall eintritt, den Wasserstoff anders als zu 1/10
oder 1/20 des Volumens zuzusezen. Dann bestimme ich mittelst des Gegebenen und der
Berechnung das Verhältniß der Gase in dem Augenblik, wo die lezten Fleken erhalten
wurden. Folgendes Resultat gab der Versuch. 9/10 von 5/6 von 4/5 von 0,08 Cent. =
0,045 Cent.
Wirklich geben 0,045 Cent. Arsenikwasserstoff, gemengt mit 2 Liter Wasserstoff, noch
schwache Fleken; sezt man aber nur noch 1/10 Wasserstoff hinzu, so ist es unmöglich,
nur noch eine Spur Arsenik aufzusammeln. Das Verhältniß der Gase, im Moment, wo sie
an die Gränze ihrer Empfindlichkeit gelangen, ist demnach 1/44444.
Sollten zufällig nach dem Zusaz noch eines Zehntheils Wasserstoff noch einige höchst
unbedeutende Fleken erscheinen, so müßte man aus den beiden lezten Operationen die
Mittelzahl nehmen, um den so eben erwähnten Punkt zu erhalten, welcher sich durch
die Gegenwart zahlreicher, wenn gleich schwacher, Fleken charakterisirt, so wie
durch ihren gänzlichen Mangel, wenn die Gase mit noch 1/10 Wasserstoff verdünnt
werden.
Destillirter Zink wurde auf die so eben angegebene Weise behandelt, wobei ich fand,
daß er nur ein Verhältniß von 1/25000 anzuzeigen im Stande war. Diese Differenz in
den Zahlen, welche das Verhältniß der auf denselben Punkt gelangten Gase ausdrüken,
kann nicht einer Veränderung des Normalgases zugeschrieben werden, weil ein
unmittelbar nach dieser Operation mit dem ersten Zink angestellter Versuch mich
wieder zu dem ersten Resultate führte.
Eine große Anzahl Versuche bewiesen mir, daß dieses Verhältniß, welches nicht
veränderlich war, wenn der Wasserstoff aus demselben Zink gewonnen war, wechselte,
wenn lezteres einen anderen Ursprung hatte.
Folgende Tabelle wird von diesen Differenzen eine Vorstellung geben:
Temperatur 15° C.
Druk 0,76 Met.
Wasserstoff.
Arsenikwasserstoff.
Verhältniß.Dieses Verhältniß drükt die Gränze der Empfindlichkeit der
mittelst der Zinke A, B, C u.s.w.
erzeugten Gase aus.
A destillirter
Zink
2000 Cent.
0,08
Cent.
1/25000
B deßgl.
ebenso
0,075 –
1/26666
C gewalzter
Zink
ebenso
0,0725 Cent.
1/27586
D gekörnter
–
ebenso
0,055 –
1/36363
E destillirter
Zink, aus derselben Quelle, wie der
vorausgehende,
ebenso
0,055 –
1/36363
F gekörnter
Zink
ebenso
0,045 –
1/44444
G gekörnter
–
ebenso
0,035 –
1/57142
Da keine dieser Zinksorten mit dem Marsh'schen Apparat Fleken gibt, müßte man auf den ersten Anblik denken,
daß die Zinke F und G,
welche ein geringeres Verhältniß von Arsenikwasserstoffgas angeben, bei feinen
toxikologischen Untersuchungen den Vorzug verdienen; allein, abgesehen vom Schwefel
und Antimon, könnten diese Zinke nicht Arsenik enthalten, dessen Vorhandenseyn, wenn
auch auf gewöhnliche Weise nicht entdekbar, doch unter dem Einflüsse der organischen
Substanzen an den Tag kommen dürfte?Als das von der Académie des sciences
vorgeschlagene Verfahren mir bekannt wurde, suchte ich mich zu vergewissern,
ob ich mich in meinen Muthmaßungen nicht geirrt habe; allein ich überzeugte
mich, daß mehrere Zinksorten des Handels, welche mit dem Marsh'schen Apparate keine Fleken geben, bald
Arsenik, bald Antimon, und bald beide enthalten. Der oft darin enthaltene
Schwefel kann durch Papier, welches mit essigsaurem Blei getränkt ist und
das man in die Röhre bringt, durch welche die Gase sich entwikeln, sehr
leicht entdekt werden.
Dieser Verdacht wurde bald bestätigt, als ich die Gränze der Empfindlichkeit eines
Gases benuzen wollte, um die wägbare Menge arseniger Säure, welche einer thierischen
Substanz beigemengt war, zu bestimmen. In der That, wenn man jeden Bruchtheil des
Volumens des erhaltenen Gases durch ein gleiches Volumen Wasserstoff ersezt, bis man
die Glänze der Empfindlichkeit erreicht hat, so kann diese, welche nun bekannt ist,
dazu dienen, die am Anfange der Operation im Apparat enthaltene Menge
Arsenikwasserstoff zu ermitteln; zieht man ferner noch die Dichtigkeit und
Zusammensezung des Arsenikwasserstoffs zu Rathe und bringt die Temperatur und den
Luftdruk in Rechnung, so wird man mittelst Berechnung die Menge arseniger Säure,
welcher dieses Volumen Arsenikwasserstoff entspricht, leicht bestimmen können.
Bedient man sich einer reinen Normallösung von arseniger Säure, so erhält man die
befriedigendsten Resultate, wie die folgenden Ziffern zeigen.
Angewandtearsenige Säure.
Gefundenearsenige Säure.
Differenz.
M.
G.
M.
G.
M. G.
Mit dem Zink A
0,25
0,239
0,011
Mit dem Zink E
0,25
0,241
0,009
–––––––––
Mittelzahl
0,01
Bringt man eine vorher mit Schwefelsäure oder salpetersaurem
Kali präparirte animalische Substanz dazu, so findet man sich veranlaßt, mehr
arsenige Säure vorhanden zu glauben, als dazu genommen wurde. Es muß sich also zu
gleicher Zeit mit dem Wasserstoff und dem Arsenikwasserstoff ein anderes gasartiges
Product entwikelt haben, welches die Eigenschaft besizt, das Verschwinden der
Arsenikfleken zu verzögern. Ist dem also, so muß dasselbe Product ihr Erscheinen
beschleunigen und folglich Spuren von Arsenikwasserstoff sichtbar machen, welche es
ohne ihre Gegenwart nicht wären.
(A.) 2 Liter Wasserstoff, durch den Zink A erzeugt, wurden mit 0,26 Kubikcent. Arsenikwasserstoff
in den Apparat gebracht. Die Flamme zeigte, wie wohl zu erwarten war, keine Spur von
Arsenik an. Um die Fleken sichtbar zu machen, hätten sich die Gase in einem
Verhältniß von wenigstens 1/25000 befinden, d.h. man hätte den 2 Litern Wasserstoff
0,08 Cent. Arsenikwasserstoff zusezen müssen.
(B.) 200 Gramme Leber wurden nach dem Danger-Flandin'schen
Verfahren behandelt; die gelbe Lösung wurde mit Zink A
und reiner Schwefelsäure so zusammengebracht, daß 2 Liter Wasserstoff in der
Gasometer-Flasche angesammelt werden konnten. Das Gas gab beim Versuche keine
Fleken; man brauchte aber, um diese zu Wege zu bringen, nur 0,05 Cent.
Arsenikwasserstoff zuzusezen, während in dem vorhergehenden Versuche 0,06 Cent. dieß
nicht bewirken konnten.
(C.) 200 Gramme Leber wurden mit salpetersaurem Kali
gemengt, getroknet und dann portionenweise in einen rothglühenden Tiegel geworfen.
Die mittelst Wasser ausgezogene Kohle erzeugte eine wenig gefärbte Flüssigkeit,
welche mit Schwefelsäure behandelt und bis zur Trokne verdampft wurde. Der in Wasser
wieder aufgelöste Rükstand gab eine ungefärbte Flüssigkeit, die, wie im vorigen
Versuche behandelt, dasselbe Resultat lieferte.
(D.) 200 Gramme Leber gaben, ebenso mit salpetersaurem
Kali behandelt, 200 Gramme einer ungefärbten Flüssigkeit, welche in Verbindung mit
Schwefelsäure auf Zink G gegossen wurde. Dieser Zink, im
gewöhnlichen Marsh'schen Apparate geprüft, gab keine
Fleken; unter dem Einflüsse der zugesezten Flüssigkeit aber zeigte er bald das
Vorhandenseyn von Arsenik an.
Die in allen diesen Versuchen erhaltenen Fleken waren in ihrem Ansehen von den rein
arsenikalischen Fleken verschieden; sie waren von gelblicher Farbe, flüchtig,
spiegelnd, von Metallglanz, sogar in der Wärme in Salpetersäure schwer löslich; aber
die zur Trokne verdunstete Lösung erzeugte mit salpetersaurem Silber den
charakteristischen ziegelrothen Niederschlag.
Vergleicht man die Versuche A, B, C und D, so scheint mir die Annahme unerläßlich, daß einer
oder mehrere Stoffe organischen Ursprungs, oder solcher, die sich unter dem
Einflüsse der angewandten Agentien bilden, merklich auf das Erscheinen der Arsenikfleken einwirken. Die
Beobachtung, daß diese Fleken immer eine mehr oder weniger gelbe Farbe hatten; daß
die Flamme im Augenblik ihres Erscheinens blau gefärbt war, daß sie sich in
Salpetersäure schwer auflösten, durch einen einzigen Tropfen
schwefelwasserstoffsauren Ammoniaks hingegen sogleich verschwanden, machte mich
glauben, daß der Schwefel wohl die gelbe Substanz sey, welche den Arsenik
begleitet.Seitdem diese Arbeit der Société
d'Emulation mitgetheilt wurde, beobachteten die HHrn. Fordos und Gélis unter andern
Umständen die Erzeugung von Schwefelarsenikfleken, deren Merkmale sie
beinahe eben so beschrieben.
Eine kleine, an beiden Enden geschlossene Röhre, welche in der Mitte mit einer
Oeffnung versehen war, wurde so gebogen, daß sie eine Art Retorte mit Recipienten
vorstellte. An einem Ende befand sich eine Lösung von salpetersaurem Baryt; am
andern die salpetersaure Lösung der in den Versuchen B
und C erhaltenen Fleken. Als dieses Ende erhizt wurde,
trübte sich die erstere Flüssigkeit; die Fleken enthielten demnach Schwefel.
Der Zink A läßt, wenn er mit Schwefelsäure oder Salzsäure
behandelt wird, keinen Schwefelwasserstoff entweichen. Hingegen kömmt dieses Gas zum
Vorschein, wenn man eine Flüssigkeit hinzubringt, welche durch Einwirkung des
Wassers auf animalische Stoffe erzeugt wurde, die man auf die obenerwähnte Weise
präparirte. Wie soll nun die Gegenwart des Schwefels hier erklärt werden? Ich
glaube, daß gegen das Ende der Verkohlung der Substanzen mittelst der Schwefelsäure,
ein Theil der durch die Reaction der Säure auf die Kalksalze erzeugten
schwefelsauren Salze sich in Schwefelmetalle umwandelt, welche sich dann im Wasser
auflösen. Was jenen Schwefel betrifft, welchen auf andere Art gewonnene
Flüssigkeiten manchmal enthalten, so kann ich ihn nur der animalischen Substanz
selbst zuschreiben, deren Schwefel zuerst unter dem Einflüsse des salpetersauren
Kali's in den Zustand schwefelsaurer Salze und dann unter jenem der Kohle in den
Zustand der Schwefelmetalle übergeht. Sezt man nicht vor dem Abdampfen der
Waschwasser einen Ueberschuß von Schwefelsäure hinzu, so entgeht ein Theil dieser
Schwefelverbindungen der Zersezung und bildet später Schwefelwasserstoff, der die
Eigenschaft hat, das Erscheinen der Arsenikfleken zu beschleunigen.
(E) Es wurden in der That 2 Liter Wasserstoff, vom Zink
C erzeugt, in einen Apparat mit 0,06 C.
Arsenikwasserstoff gebracht, welches Verhältniß nicht hinreichte, um die Gegenwart
des Arseniks zu entdeken. Der Zusaz eines gewissen Volumens Schwefelwasserstoff zur
Mischung rief sogleich das Erscheinen von Fleken hervor, die in Betreff ihrer physischen und
chemischen Kennzeichen den in den Versuchen B, C und D erhaltenen Fleken vollkommen ähnlich waren. Damit
diese Erscheinung recht sichtbar auftrete, muß darauf Acht gegeben werden, daß die
schwefelhaltige Substanz im Verhältniß zum Arsenikwasserstoff in Ueberschuß
vorhanden ist; doch darf das Maaß nicht zu sehr überschritten werden, weil sonst der
Schwefel sich in zu großer Quantität auf der Porzellantasse absezt und die Gegenwart
des Arseniks maskirt.
Auf diese verschiedenen Versuche mich stüzend, bin ich zu glauben geneigt, daß der
Schwefelwasserstoff die Substanz ist, welche das Erscheinen der Arsenikfleken
beschleunigt und zwar erkläre ich mir folgendermaßen die Rolle, welche er bei dieser
Erscheinung spielt. Indem er zu gleicher Zeit mit dem Arsenikwasserstoff in die
Flamme gelangt, zersezt er sich, bildet zum Theil schweflige Säure, welche sich
entwikelt, und läßt anderntheils Schwefel fallen, welcher Arsenik in gebundenem
Zustand zurükhält. Dieses Sulphurid muß also, da es mehr Masse ausmacht als das
Metall, welches es enthält und weniger flüchtig ist, auf dem Porzellan früher
erscheinen als der Arsenik selbst.
Die meisten Zinke des Handels entwikeln mehr oder weniger Schwefelwasserstoff, wenn
man sie mit einer Säure behandelt; doch ist diese Quantität nie groß genug, um die
Erzeugung von Schwefelarsenik hervorzurufen, welcher sich nur bei vorhandenem
Ueberschuß von Schwefelgas bildet. Jedoch ist nicht zu zweifeln, daß das aus dieser
Quelle herrührende Gas seinestheils zu der eben angeführten Erscheinung
beiträgt.
Ich wollte die Versuche B und C mit einer Auflösung von SalpeterkohleD.h. einer Kohle, welche man bei der Zersezung animalischer Stoffe mittelst
Salpetersäure erhält.A. d. R. wiederholen; allein die Schwierigkeiten, die Gegenwart salpetersaurer und
salpetrigsaurer Dämpfe in den Gasen zu vermeiden, deren Existenz unverträglich ist
mit jener des Arsenikwasserstoffs und des Schwefelwasserstoffs, erlaubte mir nicht,
hinreichend genaue Beobachtungen anzustellen. Jedoch bemerkte ich zuweilen ein
Zurükbleiben in dem Erscheinen der Fleken, was zu beweisen scheint, daß diejenigen
Chemiker, welche die Salpetersäure zur Zerstörung der animalischen Substanz
anwandten, sich in die für die Entdekung des Arseniks ungünstigsten Umstände
versezten.
Folgerungen.
1) Wenn die Oeffnung, durch welche sich die Gase entwikeln, einen Millimeter im
Durchmesser hat, so ist die Flamme, welche die größtmögliche Empfindlichkeit besizt, jene, welche aus der
Verbrennung zweier Centimeter Gas in der Secunde hervorgeht; der Marsh'sche Apparat ist daher keineswegs desto
empfindlicher, je schwächer seine Flamme ist.
2) Wenn keine secundäre Ursache die Reaction stört, zeigt reiner Zink die Gegenwart
von Arsenik an, wenn die erzeugten Gase sich wenigstens in dem Verhältniß von
1/25000 befinden.
3) Wenn die Zinke des Handels ein geringeres Verhältniß anzuzeigen scheinen, so
enthalten sie fremdartige Substanzen, Schwefel, Antimon, Arsenik, deren Gegenwart in
den Gasen das Gesez ihrer Empfindlichkeit verändert.
4) Der Schwefel, sowohl wenn er von der Zersezung organischer Substanzen, als aus den
angewandten Reagentien herrührt, besizt die Eigenschaft, das Erscheinen der
Arsenikfleken zu beschleunigen, folglich auch die Spuren Arseniks sichtbar zu
machen, welche zuvörderst der Empfindlichkeit des Marsh'schen Apparats entgangen wären.
5) Wenn man mittelst der Wärme und eines Ueberschusses von Schwefelsäure die
Sulphuride in der der Analyse unterworfenen Flüssigkeit zersezt, so ist es mit
meinem Apparate und mit Hülfe der bekannten Gränze der Empfindlichkeit eines Gases
möglich, die Spuren arseniger Säure, welche in einer Flüssigkeit enthalten sind,
(quantitativ) zu bestimmen, welche Spuren sonst durch die empfindlichste Waage nicht
mehr bemessen werden könnten.
Dieß dient zur Erklärung des Irrthums, in welchen mehrere Chemiker verfielen, welche,
keinem Zinke mißtrauend, den sie im Marsh'schen Apparat
geprüft hatten, der Substanz, welche sie untersuchten, den Arsenik zuzuschreiben
sich verleiten ließen, welchen sie in den Fleken fanden. Um sich in diesem Sinne
auszusprechen, brauchten sie nur einen dem Zink G
ähnlichen anzuwenden, dessen Arsenik nur durch die Einwirkung des
Schwefelwasserstoffs zu Tage kam. Wenn dem nun also ist, so darf man sich nicht
wundern, daß andere Chemiker, welche dieselben Substanzen untersuchten, zu anderen
Resultaten gelangten, wenn sie, abgesehen von den verschiedenen Umständen, in die
sie sich versezt haben konnten, sich eines Zinks von anderer Beschaffenheit
bedienten, welcher sich dem Zustand der Reinheit mehr näherte, als der eben
besprochene.
Tafeln