| Titel: | Ueber Pesier's Natrometer zur Bestimmung des Natrongehalts der käuflichen Potasche; Bericht von Gaultier de Claubry. |
| Fundstelle: | Band 123, Jahrgang 1852, Nr. XXI., S. 136 |
| Download: | XML |
XXI.
Ueber Pesier's Natrometer zur Bestimmung des
Natrongehalts der käuflichen Potasche; Bericht von Gaultier de Claubry.
Aus dem Bulletin de la Société
d'Encouragement, September- und Oktoberheft
1851.
Mit Abbildungen auf Tab.
II.
Gaultier de Claubry, über Pesier's Natrometer.
Die Potasche, welche in mehreren Gewerben häufig angewandt wird, läßt sich bei sehr
vielen Operationen durch die Soda ersetzen; es gibt aber auch Fälle wo dieß nicht angeht, z.B. bei der
Darstellung des Bleiglases, wo die Potasche ein Product von größerer Farblosigkeit
liefert, und bei der Fabrication weicher Seifen, wo sich die Potasche nicht durch
Soda ersetzen läßt.
Beim Bleichen kann man sowohl Potasche als Soda anwenden; da jedoch die Potasche
stets höher im Preise steht als die Soda, so wird der Consument oft betrogen, denn
man fabricirt unter der Benennung Potasche in Frankreich ein Product welches nur kohlensaures Natron enthält und dem man durch jetzt
wohl bekannte Verfahrungsarten die äußeren Eigenschaften der Potasche ertheilt.Künstliche Potasche (potasse factice) nennt man
in Frankreich ein Handelsproduct welches in der That bloß aus Soda und
Natronsalzen besteht. Man hatte seit langer Zeit die nützlichen Wirkungen
der (auftischen geschmolzenen Potasche aus Amerika beim Bleichen der
Leinwand beobachtet. Um nun mit der Soda ähnliche Wirkungen hervorzubringen
und zugleich dem allgemeinen Vorurtheil zu begegnen welches gegen die künstliche Soda herrschte, kam ein Fabrikant
Namens Ador auf den Gedanken, die Soda in Form
der so geschätzten röthlichen Potasche zu bringen. Um dieses zu erzielen,
machte er die Soda mittelst Kalk caustisch, dampfte die Auflösung ab und
versetzte sie mit 33 bis 40 Procent (vom Gewicht der trocknen Substanz)
Kochsalz, um den alkalimetrischen Grad der Soda von 75 oder 80 auf 56 oder
62, nämlich den Grad der gewöhnlichen Potaschesorten, zu vermindern.Das zugesetzte schmelzbare Kochsalz schadete dem Präparat durchaus nicht,
aber es mußte der Substanz auch die charakteristische röthliche Farbe der
amerikanischen Potasche ertheilt werden, woran sich die Consumenten hielten;
der Erfinder gelangte dazu, nicht mittelst Eisenoxyds, welches die natürliche Potasche färbt und das nicht leicht in
der Masse gut vertheilt werden kann, sondern mittelst Kupferoxyduls, welches er innerhalb der geschmolzenen Masse
erzeugte. Dazu braucht man nur auf 100 Th Soda im Flammofen zuerst 1/2 Th.
Salpeter zuzusetzen, welcher Spuren von Schwefelnatrium in schwefelsaures
Natron verwandelt; hierauf 1 Th. Kupfervitriol, aus welchem sogleich das
Oxyd abgeschieden und dann zu rothem Oxydul reducirt wird, vermittelst des
gekohlten Gases, welches das rasche Umrühren mit einem Stück Eichenholz
erzeugt. Man schafft nun die Masse ohne Verzug aus dem Ofen.Das neue Product, welches unter dem Namen „röthliche amerikanische
Potasche“ verkauft wurde, deren äußerliches Ansehen und auch
deren Eigenschaften für das Bleichen der Zeuge es besaß, mußte nothwendig
beitragen das unbegründete Vorurtheil gegen die künstliche Soda zu besiegen;
man erfuhr bald, daß die Bleicher mit Erfolg ein Product angewendet hatten,
welches von ihnen kurz vorher unter seinem wahren Namen zurückgewiesen
worden war. Jedenfalls machte ein sehr bedeutender Absatz das Glück des
Erfinders. Alle Consumenten sind jedoch keineswegs bekehrt, denn man
fabricirt jetzt noch in Frankreich für die Provinzen Soda in Form der
amerikanischen Potasche. (Précis de Chimie
industrielle par A.
Payen, Paris
1851.)A. d. Red.
Mittelst des allgemein gebräuchlichen Alkalimeters (von Descroisilles oder Gay-Lussac) kann man
den Alkaligehalt einer Potasche oder Soda genau bestimmen, vorausgesetzt jedoch daß
sie nicht ein Gemenge der zwei Basen enthalten. Um die relativen Verhältnisse von
Kali und Natron in einem Gemenge von Potasche und Soda zu ermitteln, hat Gay-Lussac ein Verfahren angegeben, welches sich auf die
Temperatur-Erniedrigung beim Auflösen eines Gemenges von Chlorkalium und
Chlornatrium gründetPolytechn. Journal Bd. XXXII. S.
202., aber dieses Verfahren fand in den Fabriken keinen Eingang.
Seitdem man nach Dubrunfaut's Vorschlag die
Rübenzuckermelasse auf Branntwein verarbeitet und aus dem Rückstand der Destillation
Potasche fabricirt, welche stets einen beträchtlichen Antheil Natron enthält, ist es
noch wichtiger geworden, ein Probirverfahren zu besitzen, mittelst dessen man den
Gehalt der käuflichen Potasche an diesen zwei Basen genau bestimmen kann.
Es wurden hierzu einige Methoden vorgeschlagen, namentlich von Anthon und O. Henry
Polytechn. Journal Bd. XCVI. S.
46., welche mehr oder weniger genügen; ein Verfahren welches eine für den
beabsichtigten Zweck vollkommen hinreichende Genauigkeit gewährt und nur diejenigen
Kenntnisse erfordert, welche man heutzutage bei allen Fabrikanten voraussetzen darf,
entdeckte aber erst Hr. Pesier, welcher seinen Natrometer
schon im März 1846 der Société
d'Encouragement zur Prüfung übergab. Zahlreiche Versuche welche ich nach
seinem Verfahren anstellte, setzten dessen Nützlichkeit außer Zweifel. Sein
Instrument ist gerade so wie der Chlorometer und Alkalimeter bereits in Reims, St.
Quentin, Valenciennes und vielen anderen Fabrikstädten eingeführt, und wird
besonders in den Fabriken welche Potasche aus Runkelrübenmelasse bereiten,
angewandt, um die Zusammensetzung der Producte zu bestimmen. Die Fehlergränzen
betragen nach Pesier bei den Proben mit dem Natrometer
nicht über 1 Procent des Gemenges; dieß bestätigte sich auch, als ihm der Ausschuß
der Société d'Encouragement sorgfältig
bereitete Gemenge von Kali- und Natronsalzen zur Untersuchung übergab. Sein
Verfahren gründet sich auf folgende Thatsachen:
Eine gesättigte Auflösung von schwefelsaurem Kali erlangt durch den Zusatz von
schwefelsaurem Natron eine Zunahme an Dichtigkeit, welche mittelst eines Aräometers
leicht bestimmt werden kann. Für eine gegebene Temperatur ist die Dichtigkeit einer
Auflösung von schwefelsaurem Kali constant; setzt man ihr schwefelsaures Natron zu,
so erhöht sich diese Dichtigkeit um so viel, als mittelst desselben die
Auflöslichkeit des schwefelsauren Kalis zunimmt; die Wirkungen sind dieselben, man mag dem
Wasser die schwefelsauren Salze als solche zusetzen oder sie innerhalb der
Flüssigkeit durch die Einwirkung der Schwefelsäure auf die Carbonate oder Chloride
der Alkalien erst erzeugen.Pesier's sinnreiche Methode das Verhältniß der
Soda in einer natürlichen oder verfälschten Potasche zu bestimmen, beruht
also auf der Ermittelung der Dichtigkeit welche die in
schwefelsaures Natron umgewandelte Soda einer gesättigten Auflösung von
schwefelsaurem Kali ertheilt.A. d. R.
Der Erfinder glaubte anfangs daß es nöthig sey, das Chlor gänzlich zu eliminiren und
nur schwefelsaures Kali in der Flüssigkeit zu haben; durch genaue Beobachtungen
überzeugte er sich jedoch, daß das Chlorkalium die Dichtigkeit der Flüssigkeit nicht
merklich ändert, indem es einen Theil des schwefelsauren Salzes verdrängt.
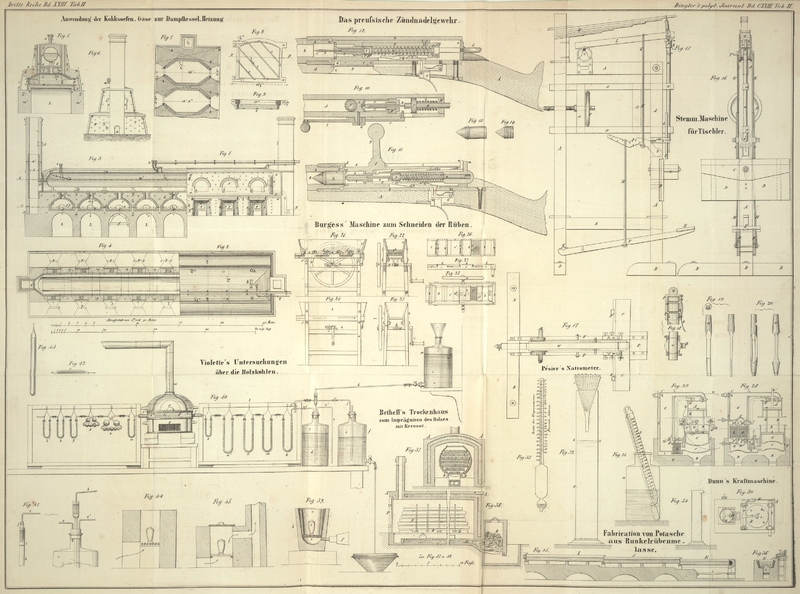
Beschreibung des Verfahrens den Natrongehalt einer Potasche zu
bestimmen.
Man nimmt aus den Fässern Potasche in Stücken oder Pulverform an verschiedenen
Stellen heraus und vermengt diese Proben um ein durchschnittliches Muster zu
erhalten; von diesem wiegt man 50 Gramme ab und gibt sie in die Flasche a
Fig. 31
(welche beiläufig 600 Gramme Wasser fassen kann); auf die Potasche gießt man
annähernd 200 Gramme Wasser und schüttelt, damit sie sich auflöst.
Setzt man nun concentrirte Schwefelsäure zu, so erfolgt ein Aufbrausen und ein
Niederschlag von schwefelsaurem Kali.
Wenn die Gasentbindung aufhört, gießt man nur noch tropfenweise verdünnte Säure zu,
um zur genauen Neutralisation des Alkalis zu gelangen; dieselbe ist bekanntlich
erreicht, sobald die Flüssigkeit weder die Farbe des gerötheten noch diejenige des
blauen Lackmuspapiers verändert.
Da bei der Einwirkung der Schwefelsäure Wärme frei wird und es nöthig ist die
Flüssigkeit auf die Temperatur der Luft zurückzubringen, so taucht man das Gefäß in
Brunnenwasser und schüttelt es von Zeit zu Zeit; wenn der Thermometer b, welchen man in die Auflösung stellte, in derselben
nahezu den nämlichen Grad zeigt, welchen er in der Luft anzeigte, so nimmt man das
Gefäß aus dem Wasser. War die Temperatur zu tief gesunken, so reicht die Wärme der
Hand hin, um sie auf den gewünschten Grad zu erhöhen. Nachdem man einige Minuten bei
der umgebenden
Temperatur geschüttelt hat, decantirt man und gießt die Flüssigkeit nach und nach
auf ein kleines Papierfilter c (Fig. 32) über dem mit Fuß
versehenen Glascylinder d.
Um den Raum bis zum Niveau h, i voll zu machen und
zugleich das dem Satz (im Filter) noch beigemengte schwefelsaure Natron auszuziehen,
wäscht man den Satz mehrmals mit einer gesättigten Auflösung von schwefelsaurem Kali
aus.
Sobald das Volum von 300 Kubikcentim. vollständig ist, nimmt man das Filter c weg, verschließt die Oeffnung des Cylinders mit der
Hand und schüttelt ihn stark, um die verschiedenen Flüssigkeitsschichten zu
vermischen. Hierauf ergreift man den Natrometer Fig. 33 an seinem oberen
Ende und senkt ihn sanft in die Auflösung. Wenn die verwendete Potasche rein war,
liest man auf der Scale zur Linken (und zwar unter der durch die Capillarität
hervorgebrachten Erhebung der Flüssigkeit an der Röhre) den Temperaturgrad ab, bei
welchem der Versuch gemacht wurde.
Enthielt hingegen die Potasche Natron, so wird man einige Grade darüber finden, deren
Anzahl auf der gegenüber befindlichen Natronscale in Procente von Natron umgesetzt
ist.
Wenn das gefundene Natron beträchtlich ist, so muß man zum zweiten Mal das Volum von
300 Kub. Cent. herstellen, indem man den Satz und das Filter mit gesättigter
Auflösung von schwefelsaurem Kali wäscht; die Quantität welche der Natrometer
anzeigt, addirt man zu derjenigen welche er anfänglich angab.
Um das in einer Lauge enthaltene Natron zu bestimmen, kann man die Flüssigkeit von
der alkalimetrischen Probe benutzen; es genügt, falls sie übersättigt wurde, einige
Tropfen Kali hineinfallen zu lassen; alsdann setzt man einen Ueberschuß von
schwefelsaurem Kali als feines Pulver zu; man rührt einige Augenblicke um, und
filtrirt fast sogleich. Nachdem man das Volum von 300 Kubikcentimetern hergestellt
hat, taucht man den Natrometer hinein, welcher direct anzeigt wie viele Kilogramme
wasserfreies Aetznatron (Natriumoxyd) ein Hektoliter Lauge enthält.
Mittelst der Tabelle Nr. 1 erfährt man, wie viele alkalimetrische Grade der
gefundenen Natronmenge entsprechen, wonach sich das Verhältniß des titrirenden (die
Probesäure neutralisirenden) Kalis leicht berechnen läßt. Diese Tabelle enthält
außer den der gefundenen Natronmenge entsprechenden alkalimetrischen Graden auch die
jedem Procent Natron entsprechende Quantität von kohlensaurem Natron, Chlornatrium
und schwefelsaurem Natron.
Tabelle Nr. 1.
Gefundenes
Natron (Natriumoxyd).
Gewöhnlichenalkalimetrischen
Graden.
Wasserfreiemkohlensaurem Natron.
Chlornatrium.
Schwefelsaurem Natron.
1 entspricht
1,57 oder
1,70 oder
1,87 oder
2,28
2
3,14
3,41
3,75
4,56
3
4,71
5,12
5,63
6,84
4
6,28
6,83
7,50
9,13
5
7,85
8,53
9,38
11,41
6
9,42
10,24
11,26
13,69
7
10,99
11,95
13,13
15,97
8
12,55
13,66
15,01
18,25
9
14,12
15,66
16,89
20,54
10
15,69
17,07
18,76
22,82
11
17,26
18,78
20,64
25,10
12
18,83
20,40
22,52
27,38
13
20,40
22,19
24,39
29,66
14
21,97
23,90
26,27
31,95
15
23,54
25,61
28,15
34,23
16
25,11
27,32
30,03
36,51
17
26,68
29,02
31,91
38,79
18
28,25
30,73
33,77
41,08
19
29,82
32,44
35,65
43,36
20
31,39
34,14
37,53
45,64
21
32,96
35,86
39,40
47,92
22
34,53
37,56
41,28
50,20
23
36,10
39,27
43,16
52,49
24
37,67
40,97
45,03
54,77
25
39,24
42,68
46,91
57,05
26
40,81
44,39
48,79
59,33
27
42,38
46,09
50,66
61,63
28
43,95
47,80
52,54
63,90
29
45,52
49,51
54,42
66,18
30
47,09
51,22
56,29
68,46
31
48,65
52,92
58,17
70,74
32
50,22
54,63
60,05
73,02
33
51,79
56,34
61,92
75,31
34
53,36
58,05
63,80
77,59
35
54,93
59,75
65,67
79,87
36
56,50
61,46
67,55
82,15
37
58,07
63,17
69,43
84,44
38
59,64
64,88
71,30
86,72
39
61,21
66,58
73,18
89,00
40
62,78
68,29
75,06
91,28
41
64,35
70,00
76,93
93,56
42
65,92
71,70
78,81
95,85
43
67,49
73,41
80,69
98,13
44
69,06
75,12
82,56
100,41
45
70,63
76,83
84,44
46
72,20
78,53
86,32
Gefundenes
Natron (Natriumoxyd).
Gewöhnlichenalkalimetrischen
Graden.
Wasserfreiemkohlensaurem Natron.
Chlornatrium.
Schwefelsaurem Natron.
47 entsprechen
73,77 oder
80,24 oder
88,19 oder
48
75,34
81,95
90,07
49
76,91
83,66
91,95
50
78,48
85,36
93,82
51
80,05
87,07
95,70
52
81,62
88,78
97,58
53
83,19
90,49
99,45
54
84,76
92,19
55
86,33
93,90
56
87,89
95,61
57
89,46
97,31
58
91,03
99,02
Die Tabelle Nr. 2 gibt die Menge von kohlensaurem Kali an, welche durch jeden
alkalimetrischen Grad repräsentirt wird.
Tabelle Nr. 2.
Alkalimetrische
Grade.
Kohlensaurem Kali.
Alkalimetrische
Grade.
Kohlensaurem
Kali.
1 entspricht
1,41
25 entsprechen
35,26
2
2,82
26
36,67
3
4,23
27
38,08
4
5,64
28
39,49
5
7,05
29
40,90
6
8,46
30
42,31
7
9,87
31
43,72
8
11,28
32
45,13
9
12,69
33
46,54
10
14,10
34
47,95
11
15,51
35
49,36
12
16,92
36
50,77
13
18,83
37
52,18
14
19,74
38
53,59
15
21,15
39
55,00
16
22,56
40
56,41
17
23,97
41
57,82
18
25,38
42
59,23
19
26,79
43
60,65
20
28,21
44
62,06
21
29,62
45
63,47
22
31,03
46
64,88
23
32,44
47
66,29
24
33,85
48
67,70
Alkalimetrische
Grade.
Kohlensaurem Kali.
Alkalimetrische
Grade.
Kohlensaurem
Kali.
49 entsprechen
69,11
61 entsprechen
86,03
50
70,52
62
87,44
51
71,93
63
88,85
52
73,34
64
90,26
53
74,75
65
91,67
54
76,17
66
93,08
55
77,57
67
94,49
56
78,98
68
95,90
57
80,39
69
97,31
58
81,80
70
98,73
59
83,21
71
100,13
60
84,62
Wenn man bei Anwendung von 50 Gram. Alkali, dessen Gehalt sich zu 60° ergab,
z.B. 8 Proc. gefunden hat, so ersieht man aus der Tabelle Nr. 1, wieviel diese
Quantität an Chlornatrium, schwefelsaurem oder kohlensaurem Natron repräsentirt; die
Tabelle gibt nämlich an, daß die gefundenen 8 Procent Natron 12°,55 am
Alkalimeter machen, und von 13,66 kohlensaurem Natron, oder von 15,01 Chlornatrium,
oder von 18,25 schwefelsaurem Natron herrühren, was anzeigt, daß das probirte Muster
soviel von dem einen oder andern dieser Salze in 100 Theilen enthält. Nun kann man
leicht berechnen; wieviel titrirendes Kali die probirte Potasche enthält; da 8 Proc.
Natron (wie gesagt) 12°,55 geben, so braucht man nur 12°,5 von den
gefundenen 60° abzuziehen, und man erhält bloß 47°,5 als dem Kali
zukommend. Die Tabelle Nr. 2 zeigt, daß diese 47°,5 durch 66,99 kohlensaures
Kali hervorgebracht werden; 47° repräsentiren nämlich 66,29 kohlensaures Kali
und die 5 Zehntelgrade 0,705. Die Addition von 66,29 und 0,705 gibt wirklich
66,995.
Wenn man die Tabellen benutzen will, nachdem die natrometrische Probe mit einer
Lauge, nämlich mit 50 Kubikcentimet. Flüssigkeit gemacht worden ist, so muß man
vorher die gefundene Natronmenge mit 10 multipliciren, denn der alkalimetrische Grad
bezieht sich auf 100 Theile Material, während die Probe nur mit dem zehnten Theil
derjenigen Quantität gemacht wurde, welche angewandt werden muß, damit der
Natrometer Procente anzeigt.
In Fig. 34 ist
ein kleines Maaß abgebildet, welches eine Quantität Schwefelsäure von 66° B.
enthält, um die Potasche bei dem genauen analytischen Verfahren zu zersetzen und die
Salze in Sulphate umzuwandeln.
Tafeln