| Titel: | Chemische Theorie des Schießpulvers; von R. Bunsen und L. Schischkoff. |
| Fundstelle: | Band 147, Jahrgang 1858, Nr. CXVIII., S. 413 |
| Download: | XML |
CXVIII.
Chemische Theorie des Schießpulvers; von R. Bunsen und L. Schischkoff.
Im Auszug aus Poggendorff's Annalen der Physik und
Chemie, 1857, Nr. 11.
Mit Abbildungen auf Tab.
VII.
Bunsen, über die chemische Theorie des Schießpulvers.
Obwohl der Verbrennungsproceß des Schießpulvers, welcher den mechanischen Effect
desselben bedingt, nach Allem, was wir darüber wissen, nichts weniger als complicirt
erscheint, so sind wir doch über die dabei auftretenden Vorgange nur höchst
unvollkommen unterrichtet; denn was auf diesem wichtigen Felde der theoretischen
Artillerie seit der ersten und immer noch wichtigsten, vor länger als 30 Jahren
publicirten Experimentaluntersuchung Gay-Lussac's gearbeitet ist, hat zu so widersprechenden
Resultaten geführt, daß man selbst gegenwärtig noch auf eine auch nur einigermaßen
mit der Erfahrung übereinstimmende chemische Theorie des Schießpulvers hat
verzichten müssen. Bekanntlich entspricht die als normal betrachtete Zusammensetzung
des Pulvers einem Gemenge von 1 At. Salpeter, 1 At. Schwefel und 3 At. Kohle.Die Kohle als reinen Kohlenstoff angenommen.
Denkt man sich den gesammten Kohlenstoff zu Kohlensäure verbrannt und den Stickstoff
als solchen ausgeschieden, so erhält man, wie die nachstehenden Zersetzungsschemata
zeigen, aus 1 Grm. Pulver 330,9 Kubikcentimeter Gas von 0° und 0,76 Meter
Druck.
C₃SKO + NO₅
3 CO₂
N KS
1 Gramm Pulver
SalpeterSchwefelKohle
0,74840,11840,1332
gibt explodirt
––––––
1,0000
Schwefelkalium
StickstoffKohlensäure
0,40780,1037 =0,4885 =
82,52
Kubikcentim.248,40 „
––––––––––––––––––––––––––
1,0000
330,92 Kubikcentim.
Dieses Gasvolumen kann sich nicht ändern, wenn statt der Kohlensäure Kohlenoxyd und
statt des Stickstoffs Stickoxyd bei der Verbrennung gebildet wird, und da in der
Regel neben ganz unerheblichen Spuren von Wasserstoff und Schwefelwasserstoff nur
Kohlensäure, Kohlenoxyd, Stickstoff und Stickstoffoxyd in den Pulvergasen auftreten,
so müssen 331 Kubikcent. als das größte Gasvolumen betrachtet werden, welches
überhaupt aus 1 Grm. normal zusammengesetzten Schießpulvers erhalten werden kann.
Ganz dem entgegen ergeben die Versuche Gay-Lussac's und der meisten späteren BeobachterPiobert, Traité d'artillerie, p.
265. für das unter gewöhnlichem Druck explodirte Pulver ein viel größeres
Volumen, als der eben angestellten Betrachtung zufolge möglicherweise hätte erhalten
werden können. Schon aus diesem Widerspruche allein läßt sich entnehmen, wie
unsicher und fehlerhaft die Methoden und Beobachtungen gewesen seyn müssen, welche
den meisten der bisherigen Untersuchungen über diesen Gegenstand zum Grunde
liegen.
Wir haben daher versucht, auf einem weniger unsicheren Wege als dem bisher betretenen
eine experimentelle Grundlage für die chemische Theorie des Schießpulvers zu
gewinnen. Es handelte sich dabei um die Beantwortung folgender Fragen:
1) Wie ist der bei der Pulverexplosion übrig bleibende feste
Rückstand zusammengesetzt?
2) Woraus besteht der Pulverrauch?
3) Welche Zusammensetzung haben die bei der Explosion des Pulvers
gebildeten Gase?
4) Wie viel Rückstand und Rauch einerseits und wie viel Gase
andererseits gibt ein bestimmtes Gewicht Pulver?
5) Wie groß ist die Verbrennungswärme des Pulvers und wie hoch
die Temperatur seiner Flamme?
6) Wie groß ist der Druck der Pulvergase, wenn das Pulver in dem
Raume, welchen es im gekörnten Zustande einnimmt, explodirt, unter der
Voraussetzung, daß keine Wärme durch Strahlung und Mittheilung verloren
geht?
7) Welches ist die theoretische Arbeit, die das Pulver zu leisten
vermag?
Die Kürze der Zeit, welche unseren gemeinschaftlichen Arbeiten zugemessen war, hat
uns leider nicht erlaubt, diese Fragen bei mehr als einer Pulversorte und bei dieser
nur für die unter gewöhnlichem Atmosphärendruck erfolgende Verbrennung in Betracht
zu ziehen. Wir geben daher auch die folgenden Versuche nicht als eine abgeschlossene
Arbeit, sondern vielmehr
nur als ein Beispiel zur Erläuterung der von uns befolgten Methode, die sich mit
kleinen Abänderungen auch zur Untersuchung von Pulververbrennungen unter anderen als
den von uns gewählten Verhältnissen benutzen läßt.
Die Zusammensetzung des zu allen Versuchen verwendeten Jagd- und
Scheibenpulvers war nach der von uns ausgeführten Analyse folgende:
Salpeter
78,99
Schwefel
9,84
Kohle
KohlenstoffWasserstoffSauerstoffSpuren
von Asche
7,69 0,41 3,07 0,00
––––––
100,00
Um zunächst nur die qualitative Zusammensetzung der festen sowohl als der gasförmigen
Zersetzungsproducte, welche das Pulver bei der Explosion liefert, kennen zu lernen,
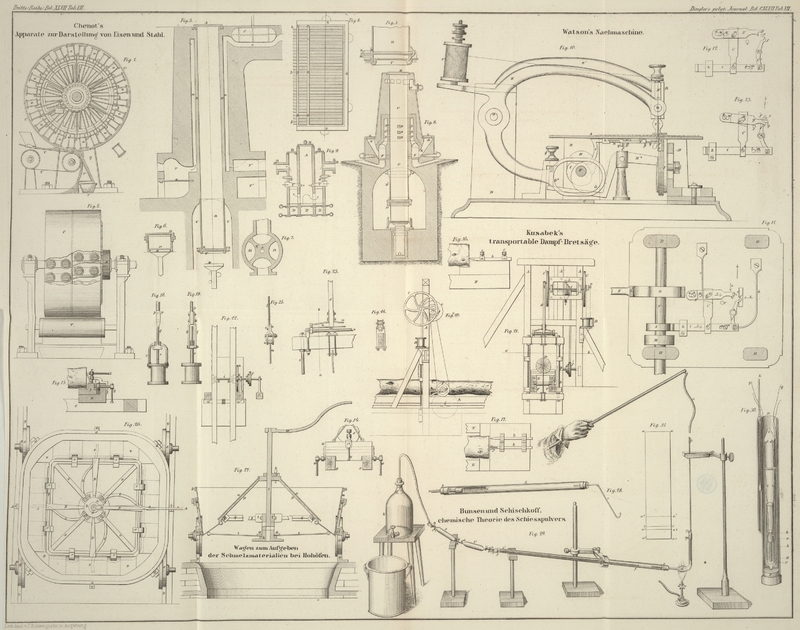
haben wir uns des kleinen Apparates bedient, welcher durch Fig. 28 dargestellt ist.
a ist ein luftdicht durch den Kork b geführtes 250 Millimeter langes und 2 Millimeter
weites Messingrohr, in welches man das fein zerriebene Schießpulver einstampft.
Dieses Röhrchen a wird, sobald das Pulver entzündet ist
und mit gleichförmiger zischender Flamme aus demselben herausbrennt, mittelst des
Korkes b in die weite Glasröhre d luftdicht eingesetzt. Das Rohr d erhitzt
sich dabei so rasch, daß es leicht an der Stelle, wo es von der Pulverflamme
getroffen wird, zerspringen kann. Um dieß zu verhüten, schiebt man ein siebförmig
durchlöchertes Blechröhrchen c; oder statt desselben
eine dünnwandige Glasröhre in die größere Röhre d,
welche dadurch vor der unmittelbaren Einwirkung der Pulverflamme geschützt wird.
Rückstand und Rauch des abgebrannten Pulvers bleiben in den Röhren a und d, während die Gase
aus dem Entwickelungsrohre e entweichen und mittelst
desselben über Quecksilber ohne Verunreinigung aufgefangen werden können, wenn man
die atmosphärische Luft durch die bei der Verbrennung gebildeten Pulvergase zuvor
verdrängt hat.
In dem mit diesem Apparate erhaltenen festen Zersetzungsproducte des Pulvers lassen
sich leicht folgende Stoffe nachweisen: 1) schwefelsaures Kali, 2) kohlensaures
Kali, 3) unterschwefligsaures Kali, 4) Schwefelkalium, 5) Kalihydrat, 6
Schwefelcyankalium, 7) salpetersaures Kali, 8) Kohle, 9) Schwefel, 10) kohlensaures
Ammoniak. Die gasförmigen Zersetzungsproducte dagegen enthalten: 1) Stickstoff, 2)
Kohlensäure, 3) Kohlenoxyd, 4) Wasserstoff, 5) Schwefelwasserstoff, und unter
Umständen erhebliche Mengen von 6) Stickoxyd und selbst Stickstoffoxydul.
Um das Material zur quantitativen Bestimmung dieser Stoffe leicht und ohne Gefahr in
größerer Menge darzustellen, haben wir uns eines andern Apparates bedient, der in
Fig. 29
abgebildet ist. a ist eine mit ungefähr 15 bis 20 Grm.
Pulver gefüllte vulcanisirte Kautschukröhre, die über den Messingaufsatz b der gegen 1 Meter langen und 2,5 Millimeter weiten
Glasröhre c gesteckt wird. Der Aufsatz b enthält eine kleine kreisrunde Oeffnung mit scharfem
Rande in dünner Platte, durch welche die Pulverkörner als möglichst feiner Strahl
wie in einer Sanduhr von dem Augenblick an herabfallen, wo man den Kautschukschlauch
in die durch Fig.
29 angegebene Lage bringt und gelinde bewegt. Bei dem Aufstecken des
Kautschukrohrs a auf die Hülse b wird dasselbe abwärts gehalten, um das vorzeitige Herabfallen von
Pulverkörnern in die Glaskugel d zu verhüten. Diese
Glaskugel, welche mit einer Lampe von außen schwach erhitzt erhalten wird, dient zum
Abbrennen des Pulvers, welches vollkommen ruhig in Gestalt einer zuckenden Flamme
vor sich geht, wenn der Pulverstrahl möglichst fein ist und continuirlich
herabfällt. Einzelne Unterbrechungen desselben, die durch leichte Bewegungen des
Schlauches a leicht beseitigt werden, sind dem Versuche
nicht hinderlich. Der feste Pulverrückstand bleibt fast vollständig in der Kugel d und ihrem Röhrenfortsatz, während sich der Pulverrauch
ohne Verlust in dem 25 Millimeter weiten und 1,5 bis 2 Meter langen Rohre e, e₁ absetzt und die gasförmigen Producte bei
e₁ in die Luft entweichen. Man kann diese
gasförmigen Producte nicht mittelst eines Entwicklungsrohres an der Mündung e₁ auffangen, denn in dem Augenblicke, wo man ein
solches Ableitungsrohr unter eine Sperrflüssigkeit taucht, bewirkt schon der Druck
der kleinsten absperrenden Wassersäule, daß die Flamme aus der Kugel d durch das Rohr c in den
Schlauch a zurückschlägt und die ganze Pulvermasse im
Rohr a entzündet. Die bei solchen Entzündungen in Massen
von 15 bis 20 Grm. Pulver bewirkten Explosionen sind zwar sehr heftig, aber selbst
für den in der Nähe mit der Handhabung des Rohres a
beschäftigten Beobachter völlig gefahrlos, da der Kautschukschlauch sogleich
zerrissen wird, ohne einen großen Widerstand zu leisten. Der gläserne Theil des
Apparates bleibt bei solchen Explosionen, die auch dann eintreten, wenn sich der
Röhrenfortsatz der Kugel d verstopft, völlig unversehrt.
Um daher ohne Gefahr einer solchen Explosion die gasförmigen Producte zur Analyse
aufzufangen, wendeten wir das mit dem Aspirator h
verbundene Saugrohr f, f an und fingen dieselben
mittelst des Aspirators in den Sammelröhrchen s₁,
s auf, welche mit Klemmschrauben verschlossen und
dann mit dem Löthrohre hermetisch abgeschlossen wurden.
Der durch Verbrennung von ungefähr 20 Grm. Pulver in der Kugel d erhaltene Rückstand bildete eine halbgeschmolzene gelblich graue
compacte Masse, die sich leicht mit Zurücklassung von etwas Kohle in Wasser löste.
Die Analyse dieses Rückstandes ergab folgende Zusammensetzung desselben:
I.
Schwefelsaures Kali
56,62
Kohlensaures Kali
27,02
Unterschwefligsaures Kali
7,57
Schwefelkalium
1,06
Kalihydrat
1,26
Schwefelcyankalium
0,86
Salpeter
5,19
Kohle
0,97
Kohlensaures Ammoniak
0,00
Schwefel, Spur
0,00
––––––
100,52
Man sieht aus dieser Zusammensetzung, daß der Pulverrückstand seiner Hauptmasse nach
aus schwefelsaurem und kohlensaurem Kali, und nicht, wie es in den besten
artilleristischen und technischen Werken angenommen wird, aus Schwefelkalium
besteht, dessen Menge im Gegentheil kaum mehr als 1 Proc. von der Gesammtmasse
ausmacht.
Um die zweite Frage über die Zusammensetzung des „Pulverdampfes“
zu beantworten, haben wir den grauen lockeren, stark nach Ammoniak riechenden, aus
condensirtem Pulverdampf bestehenden Anflug, welcher sich nach dem offenen Ende des
langen Rohres e, e₁ hin abgesetzt, für sich
aufgesammelt und analysirt. Dabei wurde folgende Zusammensetzung des Pulverdampfes
gefunden:
II.
Schwefelsaures Kali
65,29
Kohlensaures Kali
23,48
Unterschwefligsaures Kali
4,90
Schwefelkalium
0,00
Kalihydrat
1,33
Rhodankalium
0,55
Salpeter
3,48
Kohle
1,86
2/3 kohlensaures Ammoniak
0,11
Schwefel
0,00
––––––
100,00
Durch eine Vergleichung dieser Analyse (II) mit der des Pulverrückstandes (I) läßt
sich der Schluß ziehen, daß der Pulverrauch im Wesentlichen die Zusammensetzung des
Pulverrückstandes besitzt, daß darin der Schwefel und Salpeter des Pulvers etwas vollständiger
zu schwefelsaurem Kali verbrannt sind und statt der fehlenden kleinen Menge
Schwefelkalium kohlensaures Ammoniak als flüchtigeres Product in erheblichen Spuren
auftritt.
Zur Erledigung der dritten, die Natur der Pulvergase betreffenden Frage, haben wir
das zur Analyse nöthige Gas mit Hülfe des oben beschriebenen Apparats, Fig. 29,
erzeugt und aufgefangen.
Saugt man die bei der stetig erhaltenen Verbrennung des gekörnten Pulvers aus dem
Rohr e, e₁ entweichenden Gase mit dem Munde durch
die Röhre f, f auf, so zeigen sie einen Geschmack nach
fast reiner Kohlensäure. Läßt man sie durch die Nase entweichen, so bemerkt man
nicht den geringsten Geruch nach Cyan, schwefliger Säure oder Stickoxyd, sondern nur
kaum erkennbare Spuren von Schwefelwasserstoff. Mit Luft vermischt, geben sie keine
sichtbaren rothen Dämpfe. Da sich noch einige Tausendtel Cyan oder Stickstoffoxyd
oder schweflige Säure auf diese Art durch den Geruch und Geschmack erkennen lassen,
so darf man annehmen, daß diese drei Gemengtheile in dem zur Untersuchung
verwendeten Gase fehlten. Von den gasförmigen Producten, welche bei der Verbrennung
des Pulvers außerdem noch entstehen konnten, bleiben daher nur Kohlensäure,
Schwefelwasserstoff, Spuren von Sauerstoff, Kohlenoxyd, Wasserstoff, Stickstoff und
Stickstoffoxydul übrig. Die Analyse eines diese sieben Gase enthaltenden Gemenges
läßt sich nach folgender Methode ausführen. Man bestimmt zuerst im Absorptionsrohre
Kohlensäure und Schwefelwasserstoff mit Kali, und Sauerstoff mit pyrogallussaurem
Kali. Der Gasrückstand wird darauf in ein Eudiometer übergefüllt, mit überschüssigem
Sauerstoff und elektrolytischem Knallgas verpufft und der nach der Verpuffung
übrigbleibende Sauerstoff mit überschüssigem Wasserstoff verbrannt. Die nach dieser
Methode (hinsichtlich deren Details und der zugehörigen Berechnung wir auf unsere
Quelle verweisen) angestellte Analyse ergab folgende Zusammensetzung des Gases in
100 Volumtheilen:
Kohlensäure
52,67
Stickstoff
41,12
Kohlenoxyd
3,88
Wasserstoff
1,21
Schwefelwasserstoff
0,60
Sauerstoff
0,52
Stickstoffoxydul
0,00
––––––
100,00
Was zunächst bei dieser Analyse auffällt, ist der in der Glühhitze neben brennbaren
Gasen erzeugte freie Sauerstoff. Wir glauben nicht, daß die gefundenen 0,52 Proc.
desselben auf einem Fehler der Analyse beruhen, da die Genauigkeit der angewendeten
Methode und die auf die Versuche verwendete Sorgfalt einen solchen Fehler kaum
möglich erscheinen lassen. Dieser Gehalt an freiem Sauerstoff findet vielmehr darin
eine genügende Erklärung, daß der nach Verbrennung der Kohle und des Schwefels noch
immer salpeterhaltige, als Rauch zertheilte Pulverrückstand kleine Mengen
Sauerstoffs während des Erkaltens bei einer Temperatur ausgeben kann, die zur
Entzündung des bis auf das Siebzehnfache mit unverbrennlichen Gemengtheilen
vermischten Gases nicht mehr hinreicht.
Wenn das Pulver bei der Explosion, wie es die bisherige Theorie fordert, gerade auf
in Schwefelkalium, Stickstoff und Kohlensäure zerfiele, so müßten die beiden
letzteren Gase in dem Volumenverhältniß von 1 : 3 zu einander stehen. Der Versuch
zeigt aber, daß in der Wirklichkeit nicht einmal das Verhältniß 1 : 1,5 erreicht
wird. Es läßt sich daher auch aus diesem Umstande schließen, daß die Zersetzung des
Schießpulvers auf ganz anderen als denjenigen Vorgängen beruhen muß, von welchen die
alte Theorie ausgeht.
Wir können uns nun zur Beantwortung der vierten Frage wenden, der Frage nämlich, wie
viel Rückstand und Rauch einerseits und wie viel Gase andererseits ein bestimmtes
Gewicht Pulver bei dem Abbrennen liefert. Um dieselbe zu entscheiden, haben wir den
gemeinschaftlich gesammelten Rauch und Rückstand analysirt, welcher bei der
Verbrennung der Pulvermenge erhalten wurde, aus der die eben untersuchten Gase
stammen. Nach dieser und den vorher erwähnten Analysen haben das untersuchte
Schießpulver und die Producte, in die es bei dem Abbrennen zerfällt, folgende
Zusammensetzung:
A.
B.
Schießpulver.
Feste
Verbrennungsproducte.
Salpeter
78,99
Schwefelsaures Kali
62,10
Schwefel
9,84
Kohlensaures Kali
18,58
Kohle
KohlenstoffWasserstoff
Sauerstoff
7,69 0,41 3,07
Unterschwefligsaures
KaliSchwefelkaliumRhodankalium
4,80 3,13 0,45
––––––
Salpetersaures Kali
5,47
100,00
Kohle
1,07
Schwefel
0,20
2/3 kohlensaures Ammoniak
4,20
––––––
100,00
C.
Gasförmige
Verbrennungsproducte.
Kohlensäure
52,67
Stickstoff
41,12
Kohlenoxyd
3,88
Wasserstoff
1,21
Schwefelwasserstoff
0,60
Sauerstoff
0,52
Stickoxydul
0,00
––––––
100,00
Da sich der gesammte Kaliumgehalt des Schießpulvers in dem festen
Verbrennungsproducte wiederfindet, so läßt sich aus den Analysen A und B die Menge des festen
Rückstandes berechnen, welche bei dem Abbrennen von 1 Grm. Pulver erhalten wird. 1
Grm. Pulver enthält nämlich nach Analyse A 0,3055 Grm.
Kalium; die Menge Rückstand von der Zusammensetzung der Analyse B, welche eben so viel Kalium enthält, beträgt aber
0,6806 Grm.
Berechnet man den Stickstoffgehalt, welcher in diesen 0,6806 Grm. Rückstand enthalten
ist, und zieht man denselben von dem in 1 Grm. Pulver vorhandenen Stickstoff ab, so erhält man die Menge Stickstoff, welche
sich in den von einem Gramm Pulver stammenden Gasen findet. Die Gasmenge, welche
nach Analyse C diesem so berechneten Stickstoff
entspricht, wiegt 0,3138 Grm. 1 Grm. des untersuchten Schießpulvers zerfällt daher
bei dem Abbrennen in 0,6806 Grm. Rückstand von der Zusammensetzung B und in 0,3138 Grm. Gase von der Zusammensetzung C.
Die Umsetzung, welche das Schießpulver bei dem Abbrennen erlitten hat, läßt sich
daher durch folgendes Schema ausdrücken:
Textabbildung Bd. 147, S. 420
Grm. Pulver; Salpeter; Schwefel;
Kohle; gibt verbrannt; Gase; Rückstand
Bei analytischen Versuchen pflegt man gewöhnlich als Controle die Uebereinstimmung
des Gewichts der gefundenen Bestandtheile mit dem Gewichte der zur Analyse
verwendeten Substanz zu benutzen. Diese Controle ist bei diesen Versuchen nicht
anwendbar, da die Menge des zur Analyse verwendeten Pulverrückstandes nicht gewogen
wurde. Dagegen hat man dadurch eine andere gleich sichere Controle, daß sich die in
1 Grm. Pulver enthaltenen Mengen K, N, S, C, O nahezu in
unveränderter Menge in den Verbrennungsproducten wiederfinden müssen. Eine solche
Vergleichung gibt für unsere Analyse:
im unverbrannten Pulver:
K 0,3050; N = 0,1096; S = 0,0984; C = 0,0769; O = 0,4057;
im verbrannten Pulver:
K 0,3050; N = 0,1096; S = 0,0989; C = 0,0780; O = 0,3936.
Die UebereinstimmungUbereinstimmung der beiden Mengen von Kalium und Stickstoff, aus denen die
Bedingungsgleichungen zur Berechnung des obigen Schemas hergenommen sind, dienen als
Probe für die Richtigkeit der Rechnung, die Uebereinstimmung der drei Mengen von
Schwefel, Kohle und Sauerstoff als eben so viele Beweise für die Genauigkeit der
Versuche.
Aus dem Zersetzungsschema geht hervor, daß 1 Grm. Pulver bei dem Abbrennen 193,1
Kubikcentim. Gas liefert. Die Menge, welche nach der bisherigen Theorie erhalten
werden müßte, beträgt 330,9 Kubikcentimeter, also über ein Drittel mehr.
Nachdem wir die Umsetzung, auf welcher die Verbrennung des Schießpulvers beruht,
festgestellt haben, bedarf es nur noch einer Bestimmung der Flammentemperatur, um
alle Elemente zu erhalten, aus denen sich ein theoretisches Maaß für die bei der
Pulververbrennung geleistete Arbeit ableiten läßt. Wir haben uns daher noch mit der
fünften, die Verbrennungstemperatur des Schießpulvers betreffenden Frage zu
beschäftigen. Um zur Lösung derselben einen sicheren Anhaltspunkt zu gewinnen, muß
man sich zunächst eine richtige Vorstellung über die Natur der Pulverflamme bilden.
Denkt man sich 1 Grm. Pulver gleichzeitig durch seine Masse verbrannt, so werden w Wärmeeinheiten frei, durch welche die
Umsetzungsproducte des verbrannten Gramms Pulver im Momente der Verbrennung auf w/s Grad erhitzt werden, in welchem Quotienten s die mit Wasser verglichene specifische Wärme der
Verbrennungsproducte des Pulvers bedeutet. Dieser Quotient w/s ist daher die Flammentemperatur, gemessen durch die der Verbrennungswärme w zum Grunde liegende thermometrische Einheit. Die
Flammentemperatur erleidet aber in der Wirklichkeit eine stetige Erniedrigung, die
durch Wärmestrahlung und Wärmemittheilung veranlaßt wird. Da mithin die
Flammentemperatur w/s nur einen unendlich kleinen
Zeittheil constant bleibt, so ist sie durch die gewöhnlichen thermometrischen Mittel
nicht meßbar. Ganz gleiche Vorgänge finden bei der stetig brennenden Sprühflamme des
eingestampften Pulvers statt. Hier besteht zwar eine während der ganzen Dauer der
Verbrennung constante Flammentemperatur w/s, allein
diese Temperatur beschränkt sich nur auf die verschwindend kleine in der Entzündung
begriffene Schicht und nimmt von dieser aus durch Strahlung und Wärmeleitung nach
der Spitze der Flamme hin in einem stetigen Verhältniß ab. Will man daher die von
dem Verbrennungsproceß allein bedingte und nicht die von fremden Einflüssen
veränderte Flammentemperatur erhalten, so muß man dieselbe aus den Größen w und s berechnen. Da w, die Verbrennungswärme des Schießpulvers, unbekannt
ist, so haben wir dieselbe auf folgende Weise bestimmt: A (Fig.
30) ist eine messingene Röhre, die mit einer eingestampften Masse fein
zerriebenen Pulvers von bekanntem Gewicht p angefüllt
ist. In den etwas erweiterten Ansatz a dieser Röhre ist
ein gläserner Ansatz b eingekittet, an welchen zwei
Platindrähte c, c eingeschmolzen sind, die durch einen
die Pulvermasse berührenden haarförmigen Platindraht in leitender Verbindung mit
einander stehen. Dieser kleine Apparat A wird in das
unten verschlossene, oben offene Glasrohr B und dieses
mit dem darin befindlichen Apparate auf den Boden der weiten, oben noch nicht
zugeblasenen, bei d, d mit zwei feinen Oeffnungen
versehenen Glasröhre C herabgelassen. Nachdem darauf die
Drähte c, c durch die Oeffnungen d, d nach außen geführt sind, werden dieselben vor der Lampe luftdicht
eingeschmolzen und darauf auch das obere Ende der Röhre C bei e hermetisch vor der Lampe verschlossen.
Die Röhre C hat unten einen angeblasenen Zapfen, mit dem
sie senkrecht in den Kork E festgesteckt wird.
Vermittelst dieses Korkes E stellt man die ganze
Vorrichtung in die nur zur Hälfte auf der Zeichnung angegebene weite Röhre D, welche aus dem feinsten Messingblech besteht und in
welcher sich eine siebförmige Rührvorrichtung befindet, die von außen durch die
feinen Drahte g, g auf- und abbewegt werden kann.
Der so vorgerichtete Apparat, dessen gläserne, messingene und platinene Theile dem
Gewichte nach bestimmt sind, wird nun bis über die Spitze mit einer ebenfalls
gewogenen Menge Wasser gefüllt und von einem hölzernen Kasten umschlossen an einem dem
Temperaturwechsel unzugänglichen Orte bis zu einer möglichst vollständigen
Temperaturausgleichung sich selbst überlassen.
Um mit diesem Apparate die Verbrennungswärme des Pulvers zu bestimmen, bedarf man
folgender Zeit und Thermometerbeobachtungen, welche letzteren an der unmittelbar bis
auf 1/100 Centesimalgrad ablesbaren Scale des in der seitlichen Ausweitung des
blechernen Wassergefäßes befindlichen Thermometers k
vollführt werden.
Man beobachtet zunächst die Temperatur für die Zeiten t₀ und t₁, entzündet das Pulver
mittelst der galvanischen Leitung c, c, indem man die
Zeit t₂–t₁, welche von der letzten Beobachtung bis zum Eintritt der Entzündung
verfloß, notirt, und beobachtet die Zeit t₃–t₂, bis zu welcher das genau am Thermometer
abgelesene Maximum der Erwärmung eintritt. Endlich hat man noch die von dem
Temperaturmaximum an gerechneten Zeiten t₄ und
t₅ und die denselben zugehörigen abnehmenden
Temperaturen zu beobachten. Während der ganzen Dauer der Versuche wird die
Flüssigkeit vermittelst der Rührvorrichtung in Bewegung erhalten.
Ein mit großer Sorgfalt auf diese Weise ausgeführter Versuch gab folgende Werthe zur
Berechnung von w:
Beobachtete
Zeit t
Beobachtete
Thermometerstände
0'
19,86
5'
19,83
6'
19,83
Entzündung
7'
Temperaturmaximum
16'
21,10
26'
20,98
56'
20,60
Die Gewichte der einzelnen Bestandtheile des Apparates waren:
Gewicht des Glases
79,14
Grm.
„ „
Messings
132,11
„
„ „
Platins
3,50
„
„
„ Schießpulvers
0,7125
„
„ „
Wassers
376,40
„
Der Wasserwerth aller dieser Gewichte zusammengenommen entspricht 404,7 Grm. Die
Erhitzung dieser 404,7 Grm. Wasser durch die gesammte bei der Verbrennung von 0,7125
Grm. Schießpulver entwickelte Wärme ist 1°,14 C.
Die Verbrennungswärme des zu den Versuchen von uns benutzten Jagd- und
Scheibenpulvers, d.h. die Erhitzung in Centesimalgraden, welche ein Gewichtstheil
abbrennenden Pulvers in einem gleichen Gewichtstheil Wasser erzeugt, beträgt daher
643°,9.
Die so gefundene Zahl bedarf noch einer kleinen Correction. Da nämlich die
Verbrennung der zu dem Versuch benutzten 0,7125 Grm. Pulvers in dem mit Luft
gefüllten Raum des hermetisch verschlossenen Verbrennungsrohrs vor sich ging, so
mußten die bei dem Abbrennen entwickelten entzündlichen gasförmigen
Zersetzungsproducte verbrennen und dadurch eine kleine Menge Wärme erzeugen, die der
eigentlichen Pulverzersetzung fremd ist. Zufolge des Schemas D gaben die zu dem Versuche verwendeten 0,7125 Grm. Pulver
0,00669 Grm.
Kohlenoxydgas,
0,00014 „
Wasserstoff,
0,00128 „
Schwefelwasserstoff.
Nimmt man mit Favre und Silbermann die Verbrennungswärme dieser drei Gemengtheile der Reihe nach
zu 2403, 34462 und 2741 an, so beträgt die durch ihre Verbrennung erzeugte auf ein
Gramm Wasser bezogene Wärmemenge 24°,4, um welche daher jene 643°,9 zu
verringern sind. Die wirkliche Verbrennungswärme ist daher 619°,5 C. Die
Wärme dagegen, welche durch den im hermetisch verschlossenen Verbrennungsgefäß
vermehrten Gasdruck erzeugt wurde, kann bei dem Versuche füglich als verschwindend
klein vernachlässigt werden.
Berechnet man die Verbrennungswärme des Schießpulvers unter der Voraussetzung, daß
dessen verbrennliche Bestandtheile mit freiem Sauerstoff verbrennen, so erhält man
mit Zugrundelegung der von Favre und Silbermann gefundenen Verbrennungswärme des Schwefels,
der Kohle und des Wasserstoffs die Zahl 1039°, 1 C. Die durch den Sauerstoff
des Salpeters oxydirten Pulverbestandtheile geben daher viel weniger Wärme als bei
ihrer Verbrennung mit freiem Sauerstoff. Diese Thatsache kann keineswegs befremden,
wenn man erwägt, daß der ganze ungefähr 2/3 vom Gewichte der brennbaren
Pulvergemengtheile betragende Stickstoff bei seiner Umwandlung in Gas eine
bedeutende Wärmemenge binden muß.
Die Flammentemperatur des Pulvers oder die Temperatur, welche in der brennenden Masse
desselben herrschen würde, wenn keine Wärme durch Strahlung oder Leitung verloren
ginge, ergibt sich unmittelbar durch Division der Zahl 619,5 mit der specifischen
Wärme der Verbrennungsproducte des Pulvers. Die specifische Wärme läßt sich aber aus
den im Schema D angegebenen Bestandtheilen, welche in 1
Grm. abgebrannten Pulvers enthalten sind, berechnen, wenn man die in Columne b der folgenden Zusammenstellung angegebenen
specifischen Wärmen mit den entsprechenden in der ersten Columne a angegebenen Gewichten multiplicirt und die so
erhaltenen Zahlen addirt, wobei die kleinen Mengen , KCyS₂,
(NH₄)₂ ₃ und HS, deren specifische Wärme nicht bekannt
ist,
unberücksichtigt gelassen sind, da ihr Einfluß sich erst in einer Ziffer des
gesuchten Zahlenwerthes geltend macht, welche ohne erheblichen Fehler außer Acht
gelassen werden kann.
a
b
a ×
b
Schwefelsaures Kali
0,4554
–
0,1901
0,08656
Kohlensaures Kali
0,1362
–
0,2162
0,02944
Schwefelkalium
0,0229
–
0,1081
0,00248
Salpeter
0,0401
–
0,2388
0,00957
Kohle
0,0079
–
0,2411
0,00190
Schwefel
0,0015
–
0,7026
0,00031
Stickstoff
0,1075
–
0,2440
0,02623
Kohlensäure
0,2167
–
0,2164
0,04692
Kohlenoxyd
0,0101
–
0,2479
0,00251
Wasserstoff
0,0002
–
3,4046
0,00073
Sauerstoff
0,0015
–
0,2182
0,00033
––––––
–––––––
1,0000
0,20698
Dividirt man die Zahl 619,5 durch 0,207, so erhält man für die Temperatur der Flamme
des frei in der Luft verbrennenden Pulvers 2993° C.
Verbrennt das Pulver in einem geschlossenen Raume, in welchem sich die Gase nicht
ausdehnen können, so wird die Temperatur der Flamme eine andere. Man erhält diese
Temperatur, wenn man die Verbrennungswärme durch die specifische Wärme bei
constantem Volumen dividirt. Die letztere ergibt sich aber durch folgende der obigen
ähnliche Rechnung:
a₁
b₁
a₁b₁
Schwefelsaures
Kali
0,4554
0,1901
0,08656
Kohlensaures Kali
0,1362
0,2162
0,02944
Schwefelkalium
0,0229
0,1081
0,00248
Salpeter
0,0401
0,2388
0,00957
Kohle
0,0079
0,2411
0,00191
Schwefel
0,0015
0,2026
0,00031
Stickstoff
0,1075
0,2440
0,01846
Kohlensäure
0,2167
0,2164
0,03426
Kohlenoxyd
0,0101
0,2479
0,00177
Wasserstoff
0,0002
3,4046
0,00048
Sauerstoff
0,0015
0,2182
0,00023
–––––––
0,18547
Die Flammentemperatur des Pulvers, dessen Gase in einem geschlossenen Raume entstehen
und sich nicht frei ausdehnen können, ist daher 619,5/0,18547 = 3340° C.
Bestände die Flamme des Pulvers nur aus glühenden gasförmigen Stoffen, deren
Wärmecapacität, wie durch Regnault's Versuche und
Clausius' theoretische Betrachtungen erwiesen ist, sich
nicht mit der Temperatur ändert, so würde der Werth von w/s mit aller Schärfe zu bestimmen seyn. Da aber die specifische Wärme der
festen Körper mit der Temperatur zunimmt, so können die gefundenen Zahlen
2993° und 3340° nur als Näherungswerthe gelten, die indessen nach
Allem, was wir über die Größe der Zunahme der spec. Wärme mit der Temperatur wissen,
nicht weit von der Wahrheit abliegen können. Da s mit
der Temperatur wächst, so wurde w/s zu groß gefunden,
und da außerdem in der Wirklichkeit die Flammentemperatur stets durch Wärmestrahlung
und Leitung erniedrigt wird, so kann man immerhin unter allen Umständen mit
Gewißheit annehmen, daß die Temperaturen 3340° und 2993° einen
Gränzwerth darstellen, dem sich die Temperatur der Pulverflamme mehr oder weniger
nähert, den sie aber in der Wirklichkeit niemals völlig erreichen oder überschreiten
kann. Aus dieser Thatsache läßt sich ein wichtiger Schluß auf die Größe des Druckes
machen, der bei der Explosion des Pulvers in dem von demselben gravimetrisch
erfüllten Raume ausgeübt wird.
Man hat bisher allgemein angenommen, daß der Rückstand während der Verbrennung des
Pulvers in Dampfgestalt auftrete und durch seine Tension auf das Wesentlichste die
mechanischen Wirkungen des Pulvers mitbedinge. Obwohl eine geringe Verflüchtigung
dieses Rückstandes nicht geläugnet werden kann, so läßt sich doch mit Hülfe der eben
berechneten Flammentemperatur leicht zeigen, daß die durch eine solche
Verflüchtigung bewirkte Tension nicht einen Atmosphärendruck betragen kann. Die
Flammentemperatur des mit Luft verbrenenden Wasserstoffs beträgt 3259°
C.Geometrische Methoden von R. Bunsen, S. 254. Eine aus Pulverrückstand an einen haardicken Platindraht angeschmolzene
Perle verflüchtigte sich zwar allmählich vollkommen in einer in Luft verbrennenden
Wasserstoffflamme, allein sie geräth dabei nicht ins Kochen und ihre Dampftension
kann daher niemals den Druck von nur einer Atmosphäre erreichen. Der Druck, welchen
die Dämpfe der festen Zersetzungsproducte des Pulvers in Temperaturen von
2993° und 3340° ausüben, kann daher nur ein verschwindend kleiner seyn
und füglich vernachlässigt werden. Es ist dadurch die Möglichkeit gegeben, aus
unsern Versuchen das Druckmaximum zu berechnen, das bei der Verbrennung des Pulvers
in einem geschlossenen Raume noch ausgeübt, aber niemals überschritten werden
kann.
Nennt man das Gewicht Pulver Gp, die gravimetrischeDieser Ausdruck bezeichnet in der Artillerie
das Gewicht eines Kubikcentimeters Pulverkörner. Dichtigkeit
desselben Sp, das
Gewicht des aus diesen Gp Pulver erhaltenen Rückstandes Gr, die
Dichtigkeit dieses Rückstandes bei 3340° C. Sr, und das Volumen der aus jenen Gp erhaltenen bei
0° C. und ein Atmosphärendruck gemessenen Gase V,
nennt man ferner die Temperatur der in einem verschlossenen Raum brennenden
Pulverflamme t, so ergibt sich der Druck p₀, welchen das Pulver, wenn es in dem von ihm
erfüllten für Wärme undurchdringlich gedachten Raume Gp/Sr abbrennt, ausübt, aus folgender
Gleichung:
Textabbildung Bd. 147, S. 427
In dieser Gleichung ist nur eine Größe, deren Bestimmung einige Schwierigkeit
darbietet, nämlich Sr oder das specifische Gewicht des bei der Temperatur der Pulverflamme
(3340° C.) geschmolzenen Pulverrückstandes. Wir haben dieses spec. Gewicht
nach einer noch nicht publicirten Methode bestimmt, welche Einer von uns benutzt
hat, um die Verflüchtigung und Ausdehnung von in sehr hohen Temperaturen
geschmolzenen Gebirgsarten unabhängig von der Ausdehnung umschließender Gefäße zu
bestimmen. Ein nach dieser Methode ausgeführter Versuch gab mit einer zwar nur
angenäherten, aber vollkommen für die vorliegenden Zwecke ausreichenden Genauigkeit
für das spec. Gewicht des Pulverrückstandes
bei
18° C.
2,350
bei
2808° C. 1,520.
Daraus erhält man durch Interpolation für das spec. Gewicht des Pulverrückstandes bei
3340° C. Sr = 1,50. Die Werthe der in der Formel vorkommenden Größen sind daher für
das von uns untersuchte Pulver:
G
p
=
1,000 Grm.
S
p
=
0,964
„
G
r
=
0,6806 „
S
r
=
1,50
„
V
=
193,1 Kubikcentim.
t
=
3340° C.
Durch Substitution derselben in die Formel ergibt sich für p₀ der Werth 4373,6.
Berechnet man den Druck mit Zugrundelegung des spec. Gewichts hes Pulverrückstandes
bei gewöhnlicher Temperatur (2,35), so ergibt sich für p₀ der Werth 3414,6. Es kommen also von den gefundenen 4374 Atmosphären
ungefähr 1000 auf die durch Erhitzung bewirkte Ausdehnung des Pulverrückstandes.
Ein Pulver von der Zusammensetzung des von uns benutzten, welches in einem
Geschützlaufe hinter dem Geschosse explodiren und dabei die eben nachgewiesene
Zersetzung erleiden würde, kann daher in Folge des bei der Verbrennung
unvermeidlichen Wärmeverlustes niemals einen Druck auf die Geschützwandung ausüben,
der eine Höhe von 4500 Atmosphären erreicht. Ob in der Zersetzungsweise des Pulvers
wesentliche Aenderungen eintreten, wenn dasselbe frei oder unter hohem Druck im
Geschützlaufe abbrennt, wird sich aus der Zusammensetzung des in solchen Geschützen
abgesetzten Rückstandes und der dort entwickelten, leicht aufzufangenden Gase leicht
ermitteln lassen. Zeigt es sich, daß unter diesen Umständen die Zersetzungsweise im
Wesentlichen dieselbe bleibt, so müssen manche der bisherigen Annahmen über den
Druck der Pulvergase in Geschützen auf sehr fehlerhaften Voraussetzungen beruhen,
denn die besten artilleristischen Schriftsteller geben diesen Druck bis zu 50000, ja
bis über 100000Piobert, Traité d'artillerie, 1847, p.
322. Atmosphären an.
Die mitgetheilten Versuche geben zugleich ein Mittel an die Hand, das Maximum des
mechanischen Effects, d.h. die theoretische Arbeit des Pulvers, zu bestimmen, welche
dasselbe leistet, wenn sich dessen Gase unter dem ihrem jedesmaligen Volumen
entsprechenden Drucke in einem für Wärme undurchdringlich gedachten Raume ausdehnen.
Es sey a₁a₃a₃a₁ (Fig. 31) der
von dem Pulver Gp
erfüllte Raum, a₂a₃a₃a₂ das
vom Pulverrückstand G, und a₁a₂a₂a₁ das von den Pulvergasen im
Augenblicke der Verbrennung erfüllte Volumen v₀ =
Gp/Sp
– Gr/Sr, worin der
eben bestimmte Druck p herrscht; es sey endlich aa₂a₂a der Raum, welchen die Gase
einnehmen, nachdem sie sich bis zu dem Drucke p₁
ausgedehnt haben. Nennt man ferner dv die unendlich
kleine Volumenvergrößerung des Gases ca₂a₂c, so ist die während dieser Ausdehnung unter dem Drucke p₀ geleistete Arbeit p₀dv, und
die gesammte Arbeit, welche das Gas bei der gesammten Ausdehnung leistet,
Textabbildung Bd. 147, S. 429
Unter der Voraussetzung, daß ein Gas sich in einer für Wärme undurchdringlichen Hülle
ausdehnt, ist aber, wenn p₀ den zu v₀, gehörigen Druck bedeutet,Poisson, Mécanique t. II p. 647; Clausius, Poggend. Annalen Bd.
LXXIX S. 396.
p = p₀ (v₀/v)K,
wo K das Verhältniß der spec.
Wärme des Gases bei constantem Druck und constantem Volumen bedeutet; es folgt
daraus jenes Integral:
Arbeit = p₀v₀/(K –
1).
Ein Gramm des von uns benutzten Pulvers gibt für v₀ = Gp/Sp
– Gr/Sr 0,5836
Kubikcentim. und für p₀ 1029,8 × 4373,6
Grm. K ergibt sich aus der Zusammensetzung des
untersuchten Pulvergases zu 1,39. Ein Kilogr. des untersuchten Pulvers leistet
daher, wenn es die oben angegebene Zersetzung erleidet, eine theoretische Arbeit von
67410 Meterkilogramm.
Tafeln