| Titel: | Die Verbrennungsproducte der Schießwolle und des Schießpulvers, erzeugt unter Umständen, welche denen der Praxis analog sind; von Ludwig v. Károlyi. |
| Fundstelle: | Band 169, Jahrgang 1863, Nr. CXIV., S. 426 |
| Download: | XML |
CXIV.
Die Verbrennungsproducte der Schießwolle und des
Schießpulvers, erzeugt unter Umständen, welche denen der Praxis analog sind; von Ludwig
v. Károlyi.
Aus Poggendorff's Annalen der Physik und Chemie,
Bd. CXVIII S. 544.
Mit einer Abbildung auf Tab. VI.
v. Károlyi, über die Verbrennungsproducte der Schießwolle
und des Schießpulvers.
Die nach der Methode des Hrn. Generalmajor Freiherrn v. Lenk in Hirtenberg nächst Wiener Neustadt fabrikmäßig erzeugte Schießwolle
ist auf Grundlage vorangegangener Versuche nicht nur seit mehreren Jahren in der k.
k. Geniegruppe als Sprengpräparat eingeführt, sondern trotz des Umstandes, daß ihrer
Anwendung zu Geschützladungen noch Schwierigkeiten entgegen treten, wird sie auch
von der k. k. Artillerie zur Füllung der Hohlprojectile gebraucht.
Namentlich die erstere Verwendungsart veranlaßte das k. k. Geniecomité, dem
der Verf. seit zwei Jahren zugetheilt ist, unausgesetzt Arbeiten im Gange zu
erhalten, welche geeignet sind, ein erhöhtes Einsehen in das chemische Verhalten
dieses Stoffes zu verschaffen. Unter diese Arbeiten fällt auch das Bestreben, die
Verbrennungsproducte der in Hirtenberg erzeugten Schießwolle kennen zu lernen, und
es erschien im Laufe der Untersuchung gerathen, das von dem Verf. hierbei befolgte
Verfahren auch auf das Schießpulver anzuwenden.
I. Analyse der Verbrennungsproducte der
Schießwolle.
Das rasche Abbrennen der Schießwolle und die damit verbundene brisante Wirkung
verhinderte den Verf., zur Erzeugung ihrer Verbrennungsproducte Prof. Bunsen's vortreffliche MethodePolytechn. Journal Bd. CXLVII S. 413., die er zum Verbrennen des Schießpulvers behufs der Analyse der
Verbrennungsproducte ersann, zu verwenden. Der Verf. mußte vielmehr daran denken,
die Verbrennung im luftleeren Raume vorzunehmen, und hat zu diesem Ende ein
Eudiometer von nahezu 1 Meter Länge verwendet, welches zum Unterschiede von den
gewöhnlichen Eudiometern am oberen Ende, statt mit zwei Platindrähten versehen zu
seyn, von einem ganzen sehr dünnen Platindraht durchzogen war. An diesem Draht
wurden ungefähr 15 bis 20 Milligramme Schießwolle befestigt, das Rohr mit
Quecksilber gefüllt, die Luft möglichst gut daraus entfernt und durch Aufstellen in
der Quecksilberwanne Torricelli's Leere erzeugt. Mit
Hülfe einer galvanischen Batterie konnte der Draht zum Glühen, somit die Schießwolle
zur Explosion gebracht werden, worauf alle eudiometrischen Operationen in dem Rohre
wie folgt ausgeführt wurden, nachdem ein Vorversuch ergeben hatte, daß das auf diese
Weise erzeugte Gas aus Stickstoff, Stickoxydgas, Kohlensäure, Kohlenoxyd, Grubengas
und Wasserdampf bestand.
Vol.
Druck.
Temp.
Vol. bei 0°u. 1 M. Druck.
Anfangsvolumen
374,53
0,1156
12°
42,37
Im Dampfapparat
415,83
0,1768
95
54,56
Nach Absorption des NO²
361,80
0,1078
11,2
37,47
Nach Absorption der CO²
328,06
0,0850
10,5
26,85
Nach Zusatz von Luft
481,25
0,2372
12,3
109,26
Nach Zusatz von Sauerstoff
497,56
0,2510
12,5
119,41
Nach der Explosion
466,21
0,2212
11,2
99,07
Nach der Absorption der CO²
430,57
0,1855
10,4
76,97
Nach Zusatz von H
477,25
0,2301
11,7
105,29
Nach der Explosion
443,38
0,1983
12,6
84,08
Aus den Absorptionen ergibt sich der Gehalt an NO² und CO², aus der
Volumsvermehrung im Dampfapparat der Gehalt an Wasser; aus dem Volumen 76,97,
welches nach Entfernung der aus den brennbaren Gasen entstandenen Kohlensäure
zurückbleibt, erhält man nach Abzug des unverbrannten Sauerstoffs und des mit der
atmosphärischen Luft zugesetzten Stickstoffs die Menge des Stickstoffs im Gase,
während die brennbaren Gase nach den Formeln aus Bunsen's
gasometrischen Methoden
Kohlenoxyd = P₁ – (2
P₂ – P)/3,
Grubengas = (2 P₂ –
P)/3
Wasserstoff = P –
P₁
berechnet werden, in welchen P die
Menge der brennbaren Gase, P₁ die während der
Verbrennung erzeugte Kohlensäure, P₂ den zur
Verbrennung verbrauchten Sauerstoff bedeuten.
Auf 100 gerechnet enthält daher das Schießwollgas:
Dem Volum nach.
Dem Gewichte nach.
Kohlenoxyd
28,55
28,92
Kohlensäure
19,11
30,43
Grubengas
11,17
6,47
Stickoxydgas
8,83
9,59
Stickstoff
8,56
8,71
Kohlenstoff
1,85
1,60
Wasserdampf
21,93
14,28
–––––––––––––––––––––––––––––––––––
100,00
100,00
Die zur Analyse verwendete Schießwolle hatte die durchschnittliche Zusammensetzung
C²⁴H¹⁷N⁵O³⁸, woraus sich nach Abzug
der Resultate der Gasanalyse der ausgeschiedene und hier hinzugerechnete Kohlenstoff
ergibt.
Diese einfache und scheinbar tadellose Methode hat dem Verf. nun wiederholt gezeigt,
daß bei Anwendung eines etwas größeren Quantums Schießwolle unter sonst gleichen
Umständen, wenn also verhältnißmäßig ein größerer Druck der Verbrennung entgegen
gesetzt wird, das Mengenverhältniß der Verbrennungsproducte sich ändert, und zwar
vermindert sich hierbei das Quantum Stickoxydgas in dem Maaße, als sich der Druck
vermehrt. Es scheint somit die Desoxydation der Stickstoffverbindung während der
Verbrennung um so vollständiger vor sich zu gehen, je größer die Arbeit ist, welche
die Schießwolle während ihrer Verbrennung zu verrichten hat.
Dieser Umstand führte den Verfasser auf den Gedanken, der Schießwolle während der
Verbrennung einen bestimmten und zwar so geregelten Widerstand entgegen zu setzen,
daß er gerade in dem Momente weicht, wo die ihn beseitigende Schießwolle vollständig
abgebrannt ist, welche Bedingung ihn zu dem Versuche veranlaßte, in einer luftleer
gepumpten 60pfündigen Bombe ein mit Schießwolle gefülltes Gefäß, welches den
nöthigen Widerstand bietet, mittelst galvanischer Zündung zum Sprengen zu
bringen.
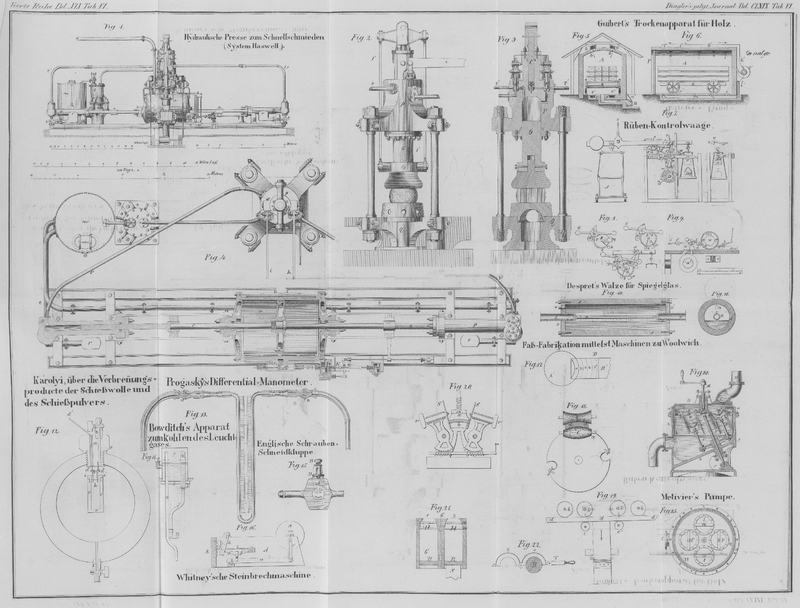
Die detaillirte Ausführung dieses Apparates ist aus Fig. 12 (1/4 der
natürlichen Größe) zu ersehen. In das Bohrloch der Bombe läßt sich ein starker
eiserner Kopf a einschrauben, welcher mit Hülfe guter
Belederung e das luftdichte Verschließen der Bombe
gestattet. Dieser Schraubenkopf ist bei b mit einem
kurzen, durch einen Hahn verschließbaren Rohre versehen, durch welchen das erzeugte
Vacuum während der ferneren Operation erhalten wird. Bei d' geht ein Kupferdraht mittelst Gutta-percha gut isolirt durch den
Kopf; bei d befindet sich ein kleiner Haken; an diesem,
wie an dem isolirten Kupferdraht, werden die mit Schießwolle geladenen und zum
Zersprengen bestimmten Gefäße mittelst isolirter Drähte angehängt, welche, wie die
Figur zeigt, die Entzündung der Ladung gestatten. Bei dem Versuche wird die Bombe
luftleer gepumpt, der Hahn verschlossen und durch den Strom einer kleinen Smee'schen Batterie von sechs Elementen der in das
Schießwollgefäß eingesetzte Platindraht zum Glühen gebracht und so das Gefäß
gesprengt. Es ist leicht einzusehen, daß man es auf diese Art in der Macht hat,
sowohl die Schießwolle unter verschiedenen Widerständen zu verbrennen als auch die
entstehenden Schießwollgase frei von atmosphärischer Luft zu erhalten.
Die Widerstandsfähigkeit der Sprenggefäße muß richtig getroffen seyn und ihr
Rauminhalt muß der Art gewählt werden, daß das nach der Explosion entstandene Gas in
der Bombe eine halbe Atmosphäre Ueberdruck besitzt, um nachmals behufs der weiteren
Untersuchung in die Meßgefäße übergefüllt werden zu können.
Die bei der Arbeit des Verf. verwendeten Explosionsgefäße, welche nach Angabe des
sel. Oberstlieutenants Br. Ebner verfertigt wurden, waren
gußeiserne, an dem einen Ende verschlossene Hohlcylinder, welche an ihrem anderen
Ende durch einen Kopf luftdicht verschlossen werden konnten, in welchem die
Vorrichtung zur galvanischen Zündung angebracht war. Zu diesem Zweck ist der Kopf
mit einer Aushöhlung versehen, in welcher ein dünner Platindraht, einerseits an dem
directen, andererseits an dem isolirt durch den Kopf gehenden Kupferdraht befestigt
wird. Die Kupferdrähte sind außerhalb des Deckels zu Oefen umgebogen, welche, wie
schon erwähnt, zur Befestigung des Cylinders an dem oberen Theile des
Bombenverschlusses, beziehungsweise zur galvanischen Stromleitung dienen.
Das Gewicht der Schießwolle, deren Verbrennungsgase die luftleere Bombe von 5216 Kub.
Cnt. Inhalt, wie oben angedeutet, mit einer hinreichenden Spannung erfüllen sollen, hat
der Verf. empirisch bestimmt und zu 10 Grm. gefunden. Da 10 Grm. Wolle, etwas
comprimirt, einen Raum von 10,5 Centim. Länge und 2 Centim. Durchmesser einnehmen,
so waren hiermit die inneren Abmessungen der Cylinder bestimmt. Die Wanddicke der
Cylinder ergab sich ebenfalls durch empirische Versuche, aus welchen folgte, daß
gerade bei 8 Millim. Wanddicke die Cylinder ohne Feuererscheinung zersprangen, also
der gemachten Bedingung gemäß auch die Schießwolle in dem Moment angebrannt war, wo
der Cylinder zersprang. Einen eigenthümlichen Umstand muß der Verf. bei dieser
Gelegenheit erwähnen, der ihm bei Bestimmung der Wanddicke der Cylinder auffiel und
zur Charakteristik der Schießwolle beitragen dürfte. Er hat nämlich zur genannten
Untersuchung der Reihe nach Cylinder von 4, 6 und 8 Millim. Wanddicke mit
Schießwolle gefüllt und in einer Grube gesprengt. Obgleich die Cylinder von 4 und 6
Millim. verhältnißmäßig eine größere Schießwollladung enthielten, waren deren
Sprengstücke doch bedeutend größer als jene der Cylinder von 8 Millim. Wandstärke.
Erstere wurden oft nur der Länge nach gespalten, ihr Deckel und Boden blieb
unversehrt, während die Sprengstücke der Cylinder von 8 Millim. Wanddicke kaum
größer als Haselnüsse waren.
Statt der eben beschriebenen Sprenggefäße könnte man ebenso gut und vielleicht
entsprechender den chemischen Laboratorien solche aus Glas herstellen. Man nimmt
sehr starkwandige Glasröhren und kittet an beiden Enden luftdicht Körke ein, nachdem
man einen derselben mit der galvanischen Zuleitung und dem Platindrähtchen versehen
hat. Die Länge der Gefäße und deren Wanddicke kann sodann der Gasmenge und dem
gewünschten Widerstand entsprechend geregelt werden.
Die qualitative Analyse der unter den oben beschriebenen Umständen erhaltenen
Verbrennungsproducte der Schießwolle ergab Kohlenoxyd, Kohlensäure, Stickstoff,
Wasserstoff, Grubengas und eine Spur einer schwefelhaltigen Gasart (wahrscheinlich
eine Schwefelkohlenstoffverbindung), welche ihrer geringen Menge wegen der Analyse
entgieng und nur durch den Geruch wahrgenommen werden konnte. Diese rührt
vermuthlich von der der Schießwolle anhaftenden Spur von Schwefelsäure her, welche
als solche entweder dem Auswaschen entgieng oder durch das nachmalige Auslaugen in
Potasche als schwefelsaures Salz zurück blieb.
Die quantitative Gasanalyse wurde nach dem folgenden Absorptions- und
Verbrennungs-Analysen-Schema vorgenommen:
Absorptions-Analyse
Vol.
Druck.
Temp.
Vol. bei 0°u. 1 M. Druck.
Anfangsvolumen
114,78
0,6242
19,1
66,94
Nach Absorption der CO²
84,88
0,6048
20,2
47,81
Verbrennungs-Analyse
Anfangsvolumen
159,38
0,3144
19,8
46,72
Nach Zusatz von Luft
238,48
0,4108
19,4
87,75
Nach Zusatz von Sauerstoff
293,77
0,4436
18,7
121,98
Nach der Explosion
248,16
0,3954
19,1
91,71
Nach Absorption der Kohlensäure
181,12
0,3504
19,5
59,19
Nach Zusatz von Wasserstoff
251,65
0,4344
21,6
101,32
Nach der Explosion
174,85
0,3389
20,4
55,15
Die Menge der Kohlensäure ergibt sich aus der Absorptions-Analyse = 19,13. Der
Stickstoff, auf bekannte Weise gefunden, beträgt 11,37 Volume. Die brennbaren Gase
bestimmen sich aus den bereits bei der Analyse in der Torricelli'schen Leere erwähnten Formeln zu Kohlenoxyd = P₁ – (2 P₂ – P)/3 = 26,01, Grubengas = (2
P₂ – P)/3
= 6,51, Wasserstoff = P – P₁ = 2,83, wobei
P = 35,35, P₁ =
32,52, P₂ = 27,44. Die bei der Untersuchung
verwendete Schießwolle entsprach der Formel
C²⁴H¹⁷N⁵O³⁸, wonach sowohl das
directe, nicht durch den Versuch zu bestimmende Wasser, als auch die abgeschiedene
Kohle zu finden sind.
Es besteht sonach der Schießwollgas-Complex aus:
Dem Volumen nach.Kub. Cent.
Dem Gewicht nach.Grm.
Kohlenoxyd
28,95
29,97
Kohlensäure
20,82
33,86
Grubengas
7,24
4,28
Wasserstoff
3,16
0,24
Stickstoff
12,67
13,16
Kohlenstoff
1,82
1,62
Wasserdampf
25,34
16,87
––––––––––––––––––––––––––––––––––––
100,00
100,00
Wie oben erwähnt, wurden die Sprenggefäße mit 10 Grm. Schießwolle gefüllt, welche
einer genauen Messung zu Folge ein Gasquantum von 5740 Kub. Cent. bei 0° und
1 Met. Druck lieferten. Der Inhalt der Bombe ist nämlich bei 16° und 0,7382
Met. Druck 5292 Kub. C.; die bis zu diesem Druck ausströmende Gasmenge betrug 2939
K. C.; folglich gaben 10 Grm. Schießwolle 8231 K. C. bei 16° und 0,7382 M.
Druck. Berechnet man aus den Resultaten der Analyse das Gasquantum, so ergibt sich, daß 10 Grm.
Schießwolle 5764,2 K. C. Verbrennungsgase liefern, was mit der wirklichen Messung
genügend übereinstimmt.
Vergleicht man die Resultate der eben beschriebenen Analyse mit jenen der obigen in
Torricelli's Leere ausgeführten, so ergibt sich:
1) daß die Verbrennungsgase in beiden Fällen wegen ihres großen Gehaltes an
Kohlenoxyd brennbar sind;
2) daß die im luftleeren Raum erzeugten Gase eine bedeutende Menge Stickoxydgas
enthalten, während beim Verbrennen der Schießwolle unter dem richtigen Widerstande
die Stickstoffverbindung zu Gunsten der im Grubengas vorkommenden Kohle und des
Wasserstoffs desoxydirt wird, und hierdurch ein Vermehrung des Kohlenoxyds, der
Kohlensäure, des Wassers und eine Abscheidung freien Wasserstoffs veranlaßt. Hieraus
folgt, daß die rothen, sogenannten Schießwolldämpfe niemals auftreten können, wenn
die ganze Schießwolle in dem Augenblick abgebrannt ist, wo sie den ihr gesetzten
Widerstand zu beseitigen beginnt.
Beide Thatsachen haben bei der Verwendung der Schießwolle zu Sprengwirkungen eine
praktische Bedeutung.
Analyse der Verbrennungsproducte des Schießpulvers.
Nachdem die Verbrennung der Schießwolle unter Umständen, wie sie bei Minen
vorkommen, von so entschiedenem Einfluß auf die Verbrennungsproducte derselben ist,
erschien es vollkommen gerechtfertigt, zu untersuchen, wie sich das Schießpulver
unter solchen Umständen benehme. Leider konnte der Verf., da seine Untersuchungen
militärischen Zwecken gewidmet waren, nur das österreichische Gewehr- und
Geschützpulver analysiren, und somit kann man nur einen oberflächlichen Vergleich
mit den Resultaten vom Prof. Bunsen anstellen, welche
sich bekanntlich auf frei abbrennendes Jagdpulver beziehen.
Das Verbrennen des Schießpulvers geschah in ganz derselben Art und Weise in der
luftleer gepumpten Bombe, wie das Verbrennen der Schießwolle, mit dem Unterschiede
jedoch, daß wegen der geringeren Wirkung des Pulvers, und um ein gleich großes
Quantum Gas zu erhalten, der Ladungsraum der Sprenggefäße größer, hingegen die
Wanddicke derselben kleiner seyn mußte, als wie bei den Sprenggefäßen der
Schießwolle. Die Aushöhlung des Deckels wurde mit Mehlpulver angefüllt.
Die Zusammensetzung der genannten, zur Untersuchung verwendeten zwei Pulversorten
kann aus folgenden Analysen berechnet werden:
Geschützpulver. 4,5487 Grm. Geschützpulver gaben 3,3562
Grm. Salpeter und 1,1923 Grm. in Wasser unlöslichen Rückstand. Schwefelkohlenstoff
löste 0,5823 Schwefel. Der Rest war 0,6100 Grm. Kohle.
Gewehrpulver. 8,8653 Grm. Pulver hatten 6,8408 Grm.
Salpeter, der Rückstand
von 2,0245 Grm. enthielt 0,765 Grm. Schwefel und es blieben 1,2595 Grm. Rückstand an
Kohle.
Die organische Analyse der vom Schwefel gänzlich befreiten Kohle ergab:
Für das Geschützpulver:
Kohlenstoff
81,2
Wasserstoff
2,865
Sauerstoff
13,599
Asche
2,336
––––––––
100,000
Für das Gewehrpulver:
Kohlenstoff
82,9
Wasserstoff
2,99
Sauerstoff
12,14
Asche
1,97
––––––
100,000
Hieraus ergibt sich die procentische Zusammensetzung der beiden Pulvergattungen wie
folgt:
Geschützpulver.
Salpetersaures Kali
73,78
Schwefel
12,80
KohlenstoffWasserstoffSauerstoffAsche
10,880,381,820,31
Kohle
––––––
100,00
Gewehrpulver.
Salpetersaures Kali
77,15
Schwefel
8,63
KohlenstoffWasserstoffSauerstoffAsche
11,780,421,790,28
Kohle
––––––
100,00
Während das von Bunsen und Schischkoff untersuchte Jagdpulver zusammengesetzt war aus:
Salpetersaurem Kali
78,99
Schwefel
9,84
KohlenstoffWasserstoffSauerstoffAsche
7,690,413,070,00
Kohle
––––––
100,00
Zur qualitativen Analyse der Verbrennungsproducte wurden zwei Cylinder mit den zwei
Pulvergattungen gefüllt, luftdicht verschlossen und nacheinander auf die bekannte
Weise in der luftleer gepumpten Bombe zur Explosion gebracht.
Für beide Pulvergattungen ergab sich an festem Rückstand: 1) schwefelsaures Kali, 2)
kohlensaures Kali, 3) unterschwefligsaures Kali, 4) anderthalbkohlensaures Ammoniak,
5) Schwefel, 6) Kohle, 7) Schwefelkalium. Letzteres zeigte sich in dem Gewehrpulver
nur in äußerst geringen Spuren.
Die gasförmigen Verbrennungsproducte bestanden aus: 1) Stickstoff, 2) Kohlensäure, 3)
Kohlenoxyd, 4) Wasserstoff, 5) Schwefelwasserstoff, 6) Grubengas und einer sehr
geringen Menge einer Schwefelkohlenstoffverbindung, welche durch den Geruch deutlich
als die bei den Schießwollgasen bereits erwähnte Verbindung zu erkennen war. Der
ganze Gascomplex ist farblos und mit keinerlei Rauch oder Dampf erfüllt.
a) Geschützpulver. Zur
quantitativen Bestimmung der Verbrennungsproducte wurden 36,8366 Grm. verwendet.
Das in drei Absorptionsröhren eingeleitete Gas betrug 75,3 K. C., das aus der Bombe
bis zum äußeren Luftdruck ausströmende Gas betrug 5480,7 K. C. bei 16° C. und
0,749 Meter Druck; die Bombe faßt unter diesen Umständen 5216 K. C., daher lieferte
obiges Pulverquantum 7621,9 K. C. Gas bei 0° und 1 Meter Druck.
Die Absorptions-Analyse ergab:
Vol.
Druck.
Temp.
Vol. bei 0°u. 1 M. Druck.
Anfangsvolumen
90,72
0,6028
16,2
51,63
Nach Absorption von CO² und HS
53,71
0,5705
14,3
29,12
Aus der Titrirung der Kalikugel mit Jodlösung gieng hervor, daß dem
Schwefelwasserstoff 0,44 Theilstriche entsprachen, daß obige 51,63 Vol. aus 0,44
Vol. Schwefelwasserstoff, 22,07 Vol. Kohlensäure und aus 29,12 Vol. Stickstoff und
brennbaren Gasen bestehen.
Die Verbrennungsanalyse des von Kohlensäure und Schwefelwasserstoff befreiten und ins
Eudiometer übergefüllten Gases gieng nach folgendem Schema vor sich:
Vol.
Druck.
Temp.
Vol. bei 0°u. 1 M. Druck.
Anfangsvolumen
113,26
0,2729
15,6
28,8
Nach Zusatz von Luft
183,36
0,3494
16,8
60,36
Nach Zusatz von Sauerstoff
204,32
0,4295
16,4
71,79
Nach der Explosion
185,62
0,3522
15,4
61,89
Nach Absorption der CO²
167,90
0,3476
15,1
55,31
Nach Zusatz von H
224,67
0,4068
16,2
86,30
Nach der Explosion
166,38
0,3355
15,7
52,79
Bei Anwendung der bereits bei der Analyse der Schießwolle erwähnten Formeln der
gasometrischen Methoden, welche sich auf das qualitativ gleiche Gas beziehen,
ergeben sich die Werthe für Kohlenoxyd = 5,21, Wasserstoff = 3,03, Grubengas = 1,38
und Stickstoff = 19,18.
Es besteht somit das Gesammtgas auf 100 gerechnet aus:
42,74
Volumen
Kohlensäure,
0,86
„
Schwefelwasserstoff,
10,19
„
Kohlenoxyd,
2,70
„
Grubengas,
5,93
„
Wasserstoff,
37,58
„
Stickstoff.
–––––––
100,00
Zur Bestimmung der festen Rückstände wurden dieselben, nach Entfernung des
Pulvergases, in der Bombe mit heißem Wasser aufgenommen und durch einen am Boden
derselben befindlichen Hahn f abgelassen und rasch
filtrirt. Die Resultate der Analyse hat der Verf. in folgender Weise gewonnen:
1) Schwefelkalium. Die gesammte filtrirte Flüssigkeit
wurde in drei großen Kochflaschen mit gut ausgeglühtem Kupferoxyd durch einige Tage
behandelt, hierauf abfiltrirt und der Rückstand in rauchender Salpetersäure gelöst.
Mit salpetersaurem Baryt versetzt gab er 0,1015 Grm. schwefelsauren Baryt, was
0,0478 Grm. Schwefelkalium in dem Rückstand von 36,8366 Grm. Pulver entspricht.
Die vom Kupferoxyd abfiltrirte Flüssigkeit ist zum Behufe weiterer Untersuchung auf 6
Liter ergänzt worden.
2) Kohlensäure. Ein Liter dieser Flüssigkeit mit
salpetersaurem Silberoxyd versetzt, gab einen Niederschlag, bestehend aus
kohlensaurem Silberoxyd und Schwefelsilber. Mit Ammoniak behandelt löste sich das
kohlensaure Silberoxyd, wurde durch ein genau gewogenes Filter vom Schwefelsilber
abgetrennt und aus dem Filtrat mittelst Chlorwasserstoffsäure als Chlorsilber
gefällt. Das Gewicht des letzteren betrug 3,0475 Grm., was 0,4687 Grm. gebundener
Kohlensäure entspricht; also kommen der ganzen Menge des Rückstandes 2,8126 Grm.
gebundene Kohlensäure zu.
Zur Controle ist die Kohlensäure mit Manganchlorür bestimmt worden, indem 1 Liter der
Flüssigkeit, mit einer Lösung von zuvor geschmolzenem Manganchlorür versetzt,
kohlensaures Manganoxydul als unlöslichen Niederschlag fällte, welcher in einem
Kohlensäureapparat nach dem Vertreiben der Kohlensäure und wiederholtem Erwärmen bis
zum Kochen einen Gewichtsverlust von 0,4722 Grm. an entwichener Kohlensäure ergab,
entsprechend dem
gesammten Rückstand 2,8337 Grm. gebundene Kohlensäure.
3) Unterschwefligsaures Kali. Das sub 2 auf einem gewogenen Filter gesammelte Schwefelsilber wog nach dem
Trocknen bei 120° 0,2261 Grm., welche 0,1733 unterschwefligsaurem Kali
entsprechen; der ganze Pulverrückstand enthielt daher 1,0400 Grm.
unterschwefligsaures Kali.
Die Bestimmung des unterschwefligsauren Kalis wurde auch nach Bunsen's Angabe mittelst Titrirung gemacht, wozu 1 Liter Lösung mit
Essigsäure schwach angesäuert und mit Stärke versetzt bis zur blauen Färbung mit
einer Jodlösung von bestimmtem Gehalte titrirt wurde. Ein Liter erforderte 22,57 K.
C. Jodlösung, folglich enthielt nach der Formel s = α (2 KO, S²O²)/J = t, worin t = 22,57, α =
0,00517, dieser Liter 0,1746 Grm. unterschwefligsaures Kali und der gesammte
Rückstand 1,0476 Grm. dieses Salzes.
4) Anderthalb-kohlensaures Ammoniak. Nach der von
Bunsen angedeuteten Methode wurde 1/4 Liter der
Flüssigkeit mit Aetzkali gekocht, das Destillat in eine Salzsäurelösung von
bekanntem Gehalte geleitet und die hierbei nicht zu Chlorammonium umgewandelte
Salzsäure mit einer titrirten Ammoniaklösung bestimmt. Der Verf. fand α = 0,04853, die Menge der angewendeten
Salzsäure, t = 19,87 die Anzahl Bürettengrade einer
Ammoniakflüssigkeit, welche ein der angewendeten Salzsäure gleiches Volumen
Salzsäure mit t' = 41,30 Bürettengraden sättigte. Bei
Anwendung der Formel x = [2 (NH⁴O) 3
CO²]/2HCl [α (t'
– t)]/t' fand er das in einem
Viertel-Liter der ursprünglichen Flüssigkeit enthaltene
anderthalb-kohlensaure Ammoniak = 0,041275 Grm. Somit entsprechen dem ganzen
Quantum des angewendeten Geschützpulvers 0,9908 Grm. anderthalbkohlensaures
Ammoniak.
5) Kohlensaures Kali. Zieht man die dem
anderthalb-kohlensauren Ammoniak entsprechende Menge Kohlensäure = 0,5541
Grm. von der sub 3 gefundenen Gesammtmenge = 2,8337 Grm.
ab, so bleibt die dem kohlensauren Kali entsprechende Menge = 2,2796 Grm. Es enthält
somit der Rückstand des ganzen Pulvers 7,1498 Grm. kohlensaures Kali.
6) Schwefelsaures Kali. Ein Liter der Flüssigkeit mit
Chlorbaryum versetzt, gab 3,0244 Grm. schwefelsauren Baryt, was 2,2683 Grm.
schwefelsaurem Kali für einen Liter Flüssigkeit und 13,6100 Grm. für den ganzen
Rückstand entspricht.
7) Kali. Zur Bestimmung der Gesammtmenge des in den
verschiedenen Salzen
enthaltenen Kalis wurde 1 Liter mit Schwefelsäure vorsichtig zur Trockene
eingedampft und in der Platinschale heftig geglüht. Es enthielt letztere 3,8466 Grm.
schwefelsaures Kali, entsprechend 2,0786 Grm. Kali. 100 Grm. Geschützpulver
enthalten somit 33,85 Grm. Kali, was dem Resultat der Analyse über die
Zusammensetzung des Geschützpulvers sehr nahe steht.
Nachdem aus der directen Beobachtung gefunden wurde, daß 36,8366 Grm. Geschützpulver
7621,9 Kub. Cent. Gas liefern, so läßt sich dem entsprechend die Zusammensetzung der
Verbrennungsproducte dieses Pulvers wie folgt zusammenstellen:
Schwefelsaures Kali
13,61
Kohlensaures Kali
7,14
Unterschwefligsaures Kali
1,04
Schwefelkalium
0,04
Kohle
0,94
Schwefel
1,73
Anderthalb-kohlensaures Ammoniak
0,99
Stickstoff
3,60
Kohlensäure
6,40
Kohlenoxyd
0,97
Wasserstoff
0,04
Schwefelwasserstoff
0,10
Grubengas
0,15
Verlust
0,07
–––––––
36,83
wobei Schwefel und Kohle aus dem Abgang berechnet wurden.
b) Gewehrpulver. Zur
Verbrennung sind 34,153 Grm. Gewehrpulver verwendet worden.
Das Mengenverhältniß der gasförmigen Verbrennungsproducte ergab sich aus folgenden
gasometrischen Versuchen.
Absorptions-Analyse.
Vol.
Druck.
Temp.
Vol. bei 0°u. 1 M. Druck.
Anfangsvolumen
136,94
0,6331
22,1
80,21
Nach Absorption von CO² und HS
75,04
0,5824
21,9
40,46
Titrirt man die Auflösung der Kalikugel mit Jodlösung, so findet man, daß dem
Schwefelwasserstoff 0,535 Theilstriche entsprechen, wonach das obige
Pulvergasquantum zusammengesetzt ist aus:
Kohlensäure
39,22
Schwefelwasserstoff
0,53
Brennbaren Gasen und Stickstoff
40,46
–––––––––
80,21
Die Verbrennungsanalyse mit dem übergefüllten Gase ging wie folgt vor sich:
Vol.
Druck.
Temp.
Vol. bei 0°u. 1 M. Druck.
Anfangsvolumen
120,12
0,3432
20,4
38,36
Nach Zusatz von Luft
198,51
0,4263
20,3
78,77
Nach Zusatz von Sauerstoff
230,33
0,4478
20,5
95,89
Nach der Explosion
201,14
0,4323
19,6
81,47
Nach Absorption der CO²
189,46
0,4276
21,0
75,23
Nach Zusatz von H
261,02
0,4817
21,2
116,66
Nach der Explosion
174,20
0,4130
18,3
67,43
Wendet man die bereits angedeuteten, einem aus Kohlenoxyd, Grubengas und Wasserstoff
bestehenden Gascomplex entsprechenden Formeln an, so findet man:
Kohlenoxyd = 3,95, Grubengas = 2,29, Wasserstoff = 5,24 und Stickstoff = 26,88.
Somit enthielt das Gewehrpulvergas in 100 Volumtheilen:
Kohlensäure
48,90
Schwefelwasserstoff
0,67
Kohlenoxyd
5,18
Grubengas
3,02
Wasserstoff
6,90
Stickstoff
35,33
–––––––
100,00
Die festen Rückstände dieses Pulvers wurden bei dem Geschützpulver aus der Bombe mit
heißem Wasser entfernt und die abfließende Flüssigkeit rasch filtrirt.
Der Gang der Analyse war folgender:
1) Schwefelkalium. Das ganze Quantum der eben genannten
Flüssigkeit wurde mit einer genügenden Quantität gut ausgeglühtem Kupferoxyd
versetzt und in drei wohl verschlossenen Flaschen bei öfterem Umschütteln
aufbewahrt, sodann abfiltrirt. Der Niederschlag, in rauchender Salpetersäure gelöst,
gab eine Flüssigkeit, in welcher salpetersaurer Baryt keinen Niederschlag
hervorbrachte; somit war kein Schwefelkalium in den festen Rückständen.
2) Kohlensäure. Die vom Kupferoxyd abfiltrirte Flüssigkeit
ist wie beim Geschützpulver auf 6 Liter ergänzt worden, in einem derselben mit einer
Lösung von geglühtem Manganchlorür der Niederschlag, kohlensaures Manganoxydul,
erzeugt und die Kohlensäure in einem Kohlensäureapparat aus dem Gewichtsverlust
bestimmt. Es entwichen 0,4616 Grm. Kohlensäure, gebunden an Kali und Ammoniak. Dem
ganzen Rückstand entsprechen hiernach 2,7701 Grm. gebundene Kohlensäure.
3) Anderthalb-kohlensaures Ammoniak. Ein
Viertel-Liter Flüssigkeit, nach der beim Geschützpulver angedeuteten Methode
mit Aetzkali behandelt, gab die Werthe:
α = 0,05783, t = 22,09, t' = 36,75
für die Formel
Textabbildung Bd. 169, S. 439
wonach einem Viertel-Liter 0,037825 Grm.
anderthalb-kohlensaures Ammoniak entsprechen, daher im ganzen Rückstand
0,908,3 (CO²) 2 (NH⁴O) enthalten sind.
4) Kohlensaures Kali. Nach Abzug der an Ammoniak
gebundenen Kohlensäure von der sub 2 gefundenen erhält
man 0,3770 Grm. an Kali gebundene Kohlensäure, entsprechend 7,096 Grm. kohlensaures
Kali.
5) Unterschwefligsaures Kali. Ein Liter mit Essigsäure und
Stärke versetzt, brauchte 13,03 Kub. Cent. Jodlösung zur Bläuung; nach der Formel
s = α (2
S²O², KO)/J t, worin α = 0,00517 und t =
13,03 gefunden wurde, enthält es daher 0,1008 Grm. unterschwefligsaures Kali, dem
entsprechend im ganzen Rückstand 0,6050 Grm. unterschwefligsaures Kali enthalten
sind.
6) Schwefelsaures Kali. Ein Liter mit Chlorbaryum
versetzt, gab 2,7453 Grm. schwefelsauren Baryt, entsprechend 2,059 Grm.
schwefelsaurem Kali; im Rückstand waren also 12,354 Grm. schwefelsaures Kali.
7) Kali. In einem Liter wurde das Kali an Schwefelsäure
gebunden. Bis zur Trockene abgedampft und heftig geglüht, enthielt die Platinschale
3,7641 Grm. schwefelsaures Kali, entsprechend 2,0335 Grm. Kali. Im ganzen Rückstand
waren somit 12,2010 Grm. Kali enthalten, welche sehr nahe der Salpetermenge des
ursprünglichen Pulvers entsprechen, wie aus der Analyse der Bestandtheile des
Pulvers zu ersehen ist.
Aus diesen Resultaten, sowie aus jenen der Gasanalyse, da die directe Messung
dargethan hat, daß 34,153 Grm. Geschützpulver 7738 Kub. Cent. Gas entwickeln, läßt
sich das Schema über die Verbrennungsproducte des Gewehrpulvers wie folgt
zusammenstellen:
Schwefelsaures Kali
12,354
Kohlensaures Kali
7,096
Unterschwefligsaures Kali
0,605
Kohle
0,887
Schwefel
0,397
Anderthalb-kohlensaures Ammoniak
0,908
Stickstoff
3,432
Kohlensäure
7,442
Kohlenoxyd
0,504
Wasserstoff
0,047
Schwefelwasserstoff
0,079
Grubengas
0,167
Verlust
0,237
–––––––
34,155
Wir wollen nun die bisher gewonnenen Resultate der Verbrennungsproducte beider
Pulvergattungen unter sich und mit jenen von Professor Bunsen und Schischkoff bei der Analyse des
Jagdpulvers veröffentlichten Resultaten vergleichen, wozu folgende übersichtliche
Zusammenstellung dienlich seyn wird.
I. Zusammensetzung.
Jagdpulver.
Gewehrpulver.
Geschützpulver.
Salpetersaures Kali
78,99
77,15
73,78
Schwefel
9,84
8,63
12,80
KohlenstoffWasserstoffSauerstoff
Kohle
7,69 0,41 3,07
11,78 0,42 1,79
10,88 0,38 1,82
Asche
0,00
0,28
0,31
–––––––––––––––––––––––––––––––––––––––––
100,00
100,00
100,00
II. Verbrennungs-Gase
in Volumprocenten.
Stickstoff
41,12
35,33
37,58
Kohlensäure
52,67
48,90
42,74
Kohlenoxyd
3,88
5,18
10,19
Wasserstoff
1,21
6,90
5,93
Schwefelwasserstoff
0,60
0,67
0,86
Sauerstoff
0,52
–
–
Grubengas
–
3,02
2,70
–––––––––––––––––––––––––––––––––––––––––
100,00
100,00
100,00
III. Sämmtliche
Verbrennungsproducte dem Gewichte nach.
Schwefelsaures Kali
42,27
36,17
36,95
Kohlensaures Kali
12,64
20,78
19,40
Unterschwefligsaures Kali
3,27
1,77
2,85
Schwefelkalium
2,13
–
0,11
Schwefelcyankalium
0,30
–
–
Salpetersaures Kali
3,72
–
–
Kohle
0,73
2,60
2,57
Schwefel
0,14
1,16
4,69
Anderthalb-kohlens.
Ammon.
2,86
2,66
2,68
Stickstoff
9,98
10,06
9,77
Kohlensäure
20,12
21,79
17,39
Jagdpulver.
Gewehrpulver.
Geschützpulver.
Kohlenoxyd
0,94
1,47
2,64
Wasserstoff
0,02
0,14
0,11
Schwefelwasserstoff
0,18
0,23
0,27
Sauerstoff
0,14
–
–
Grubengas
–
0,49
0,40
Verlust
–
0,68
0,19
–––––––––––––––––––––––––––––––––––––––––
100,00
100,00
100,00
Gasmenge per Grm.
Pulver
190
226,59
206,91.
Ein Vergleich dieser Resultate ergibt wohl auf den ersten Blick, daß im Wesentlichen
die Verbrennungsproducte beim Pulver von der Art, wie ihre Verbrennung geschieht,
wenig abhängig sind. Daß aber die Zusammensetzung des Pulvers von Einfluß ist, mag
schon daraus zu entnehmen seyn, daß bei Bunsen's Pulver,
welches viel Salpeter enthält, im Rückstand gegen 4 Proc. Salpeter wieder zu finden
sind, sowie andererseits im Rückstand des Geschützpulvers, welches weniger Salpeter
enthält, nahezu 7 Procent Schwefel und Kohle unverbrannt abgeschieden wurden.
Auffallender noch ist die Einwirkung der Dosirung auf die gasförmigen
Verbrennungsproducte. Man sieht, daß dort, wo der reducirende Körper überwiegend
ist, auch die Verbrennung des Kohlenstoffs unvollkommener vor sich geht. Während die
Gase des Jagdpulvers nur 3 Proc. Kohlenoxyd enthalten, hat das Geschützpulvergas
gegen 10 Proc. dieser Gasart; in demselben Sinne wächst auch die Quantität des
Wasserstoffs und des Grubengases, so daß das Geschützpulver gegen 20 Proc. brennbare
Gase enthält. Es darf daher gar nicht wundernehmen, wenn man, wie es der Versuch
gezeigt hat, die Gase des Geschützpulvers, wie jene der Schießwolle, mit einem
brennenden Span anzünden kann.
Es dürfte vielleicht keiner Schwierigkeit unterliegen, aus den Ergebnissen der
Analyse den Weg zu einer richtigen Dosirung des Pulvers anzubahnen, – doch
zieht es die Praxis vor, in dieser Hinsicht ihren eigenen empirischen Weg zu
wandeln. Jedenfalls mögen jedoch diese Ergebnisse als neuer Beleg gelten für die
Unrichtigkeit der in vielen chemischen Lehrbüchern und beinahe allen
artilleristischen Anstalten verbreiteten Ansicht, das Pulver müsse bei der
Verbrennung zu Schwefelkalium, Kohlensäure und Stickstoff zerfallen. Wenn die Praxis
keine anderen zwingenden Gründe zur Basis ihrer Dosirung besitzt als wie die
Möglichkeit, daß diese Verbrennungsproducte entstehen können, so ist es gewiß
gerechtfertigt, durch experimentelle Untersuchungen zu beweisen, daß diese
Verbrennungsproducte selbst unter den Verhältnissen, wie die Verbrennung in der
Praxis geschieht, niemals allein entstehen können, ja daß sogar eins derselben, das
Schwefelkalium, in vielen Fällen gar nicht entsteht.
Tafeln