| Titel: | Versuche über den Verbrennungsproceß und über den Widerstand welchen die Brennstoffe auf dem Roste dem Luftzutritte entgegensetzen; von C. Schinz. |
| Autor: | C. Schinz |
| Fundstelle: | Band 181, Jahrgang 1866, Nr. I., S. 1 |
| Download: | XML |
I.
Versuche über den Verbrennungsproceß und über den
Widerstand welchen die Brennstoffe auf dem Roste dem Luftzutritte entgegensetzen; von
C. Schinz.
Mit Abbildungen auf Tab.
I.
Schinz, Versuche über den Verbrennungsproceß, bezüglich der
Rauchverhütung.
Das Problem der Verhütung des Rauches bei Verbrennung von Steinkohlen ist schon
längst durch Stanley, Collier, Payen und Juckes principiell gelöst worden; diese Lösung besteht
darin, den Herd continuirlich mit kleinen Quantitäten Steinkohlen zu speisen, damit
die Kohlenwasserstoffe, welche aus den frischen Kohlen alsbald abdestilliren, wenn
solche auf bereits glühende Kohks geworfen werden, zu jeder Zeit in gleicher Menge
auftreten, so daß sie auch durch die stets fast gleichmäßig zutretende Luft in
derselben Zeit verbrannt werden, in der sie auftreten.
Aber abgesehen von den Mängeln der zu diesem Zweck vorgeschlagenen Apparate, sind
dieselben aus dem Grunde ohne praktischen Erfolg geblieben, weil man es übersah,
gleichzeitig die Mittel zu schaffen, dem Herde gerade diejenigen Luftmengen
zuzuführen, welche zur Verbrennung der Kohlenwasserstoffe und des festen
Kohlenstoffes hinreichen, so daß in den Verbrennungsproducten kein erheblicher
Luftüberschuß vorkommt.
Die zahlreichen Erfinder und Experimentatoren, welche sich seit dem Jahre 1830 mit
der Rauchverzehrung beschäftigten, haben durchgängig das zweite Problem:
„wie die geeignete Luftmenge zu beschaffen sey,“ unbeachtet
gelassen, daher die Aufgabe in praktischer Hinsicht durch dieselben nicht im
Mindesten gefördert worden ist.
Nur Einzelne derselben, wie Ebelmen, Thomas und Laurent, Schlösinger etc., haben bei ihren Versuchen die
Verbrennungsproducte der chemischen Analyse unterworfen. Diese Experimentatoren
beabsichtigten die Vollkommenheit des VerbrennungsprocessesVerbrennungsprocsses zu bestimmen, welche bei verschiedenem Brennstoffverbrauch per Stunde und per
Quadrat-Decimeter Rostfläche und bei verschiedenen Höhen der
Brennstoffschicht auf dem Rost, stattfindet; aber die von ihnen erlangten Resultate
stehen sämmtlich mit einander in Widerspruch.
Diese Widersprüche zeigen offenbar, daß beim Verbrennungsprocesse noch ein anderer
Factor einwirkt, welcher auf denselben einen wesentlichen Einfluß ausübt.
Welches ist nun dieser unbeachtet gebliebene Factor?
Die Verbrennung ist eine chemische Verbindung; eine solche erfordert aber Berührung
(Contact) der sich verbindenden Körper, ferner eine gewisse Zeit in der dieselbe
stattfinden kann, endlich eine ebenfalls Zeit erheischende mechanische Wirkung,
durch welche bereits Verbundenes entfernt wird, damit andere unverbundene Atome Raum
und Contact zu ihrer Verbindung erhalten.
Daraus folgt, daß der Verbrennungsproceß nothwendig modificirt werden muß: durch das
Verhältniß der Contactfläche welche dem Luftstrome in der Zeiteinheit dargeboten
wird.
Ein und derselbe Brennstoff wird je nach der Größe der Stücke, die auf dem Roste
liegen, bei in gleicher Zeit und in gleicher Menge durchströmender Luft eine mehr
oder weniger vollkommene Verbrennung liefern.
Der Zweck meiner Versuche war nun, diese Anschauungsweise zu prüfen und das Gesetz zu
finden, welches die vollkommene Verbrennung bedingt, nämlich eine Verbrennung bei
der weder Luftüberschuß noch unverbrannte Gase auftreten.
Zu diesem Ende ließ ich das Brennmaterial in möglichst gleichförmig großen Stücken
auslesen, und zwar Stücke von dreierlei Größe, deren Durchmesser 35, 30 und 20
Millimeter betrug. Natürlich konnte ohne eine weitläuftige und kostspielige
Bearbeitung jedes einzelnen Stückes die Größe und die Oberfläche derselben nur eine
annähernd gleichförmige seyn, und hätte man auch durch die Waage jedes Stück von
demselben Gewichte sortirt, so wäre der Zweck nicht besser erfüllt worden, da bei
ungleicher Form immer noch die Oberfläche jedes einzelnen Stückes eine ungleiche
gewesen wäre.
Da diese Stücke keine reguläre Form hatten, so konnte die Berechnung der Oberfläche
derselben eben auch nur eine annähernde seyn. Es wurde angenommen, daß dieselben
Kugeln seyen, so daß die Oberfläche jedes einzelnen Stückes = d²π ist, wenn d den Durchmesser der Stücke bezeichnet.
Bezeichnen wir ferner mit l die Länge der Seite eines
Kubikmeters und mit n³ die Zahl der Kugeln,
welche in einem hohlen Kubikmeter Platz finden, so ist n³ = (l/d)³.
Das heißt: 1 Kubikmeter Stücke von 35 Millimeter Durchmesser enthält
(1000/35)³
=
23322 Stücke
von
Durchmesser
30mm
=
(1000/30)³
=
37038 „
„
„
20mm
=
(1000/20)³
=
125000 „
Da nun ferner die Oberfläche einer Kugel vom Durchmesser
35mm = 0,035² . π
=
0,0038485 Quadratmeter ist
30mm = 0,030² . π
=
0,0028274 Q. M.
20mm = 0,020² . π
=
0,0012567 Q. M.
so folgt daß 1 Kubikmeter Stücke von
35mm Durchmesser
eine
Gesammtoberfläche
von
89,76 Quadratmeter
hat
30mm „
„
„
„
104,72 „
„
20mm „
„
„
„
157,08 „
„
Kennen wir nun den Querschnittt des Herdes und die Höhe der Brennstoffschicht auf dem
Roste, so wird sich das Volumen der Brennstoffschicht leicht berechnen lassen, und
folglich auch die Contactfläche welche die Stücke dem
durch dieselben ziehenden Luftstrome darbieten.
Um das Volumen und die Geschwindigkeit der durchströmenden Luft zu erfahren, haben
wir einfach den Querschnitt zu berechnen, welcher zwischen den Brennstoffstücken für
dieselbe übrig bleibt, und das Volumen nach dem stündlichen Consum und der Analyse
der Verbrennungsproducte zu berechnen.
Der Querschnitt zwischen den Brennstoffstücken ist und bleibt für die Flächeneinheit
derselbe, jene mögen groß oder klein seyn, denn er ist 1 – n² . d² . π.
Für Kugeln z.B. von 30mm Durchmesser ist die Zahl
derselben in horizontaler Schicht von 1 QuadratmeterQuadatmeter = n² = (l/d)² = 1111 und daher der leere Raum zwischen denselben
= 1 – 1111 . 0,03² . 0,7854 = 0,2146
Quadratmeter
und für Kugeln von 20mm = 1
– 2500 . 0,02² . 0,7854
= 0,2146 Quadratmeter.
Die chemische Analyse der Verbrennungsproducte lehrt uns zwar nur das
Mengenverhältniß der Bestandtheile kennen, nicht aber das absolute Volumen der
Verbrennungsproducte; kennt man jedoch den stündlichen Consum an Kohlenstoff,
welcher in dem Brennstoffe enthalten war, so läßt sich daraus leicht das absolute
Volumen der Verbrennungsproducte berechnen.
Wäre z.B. der stündliche Consum 0,8 Kilogr. Kohks gewesen, welche 0,692 Kilogr. Kohlenstoff
= 0,6451 Volume Kohlenstoff enthalten, und die Analyse hätte
18,155
Volumprocente
Kohlensäure und
1,431
„
Kohlenoxyd ergeben, so enthalten
die
18,155 Vol. CO²
= 9,0775 Vol. C und die
1,431 Vol. CO
= 0,7155 Vol. C
––––––
9,7930 Vol. C
und wir haben nun bloß die bei der Analyse erhaltenen Volume
nach diesem Verhältnisse 9,7930 : 0,6451 Vol. zu berechnen; so gäben
N
76,196
Vol.
=
Kub. Met.
3,987
=
3,987 N
O
0,620
„
=
„
0,040842
=
0,040842 O
CO²
18,155
„
=
„
1,195900
=
1,195900 O
CO
1,431
„
=
„
0,094265
=
0,0471325 O
––––––––––––
HO
0,735
„
=
„
0,048416
Kub. Met.
5,2708745
H
2,863
„
=
„
0,188600
atmosphärische
–––––––––––
––––––––
Luft von 0°.
100,000
Vol.
=
Kub. Met.
5,555023
Wäre nun der Querschnitt des Herdes = 0,0241407 Quadratmeter, so würde der leere Raum
zwischen den Brennstoffstücken = 0,0241407 × 0,2146 = 0,00518 Quadratmeter
seyn, und die Geschwindigkeit womit das Volumen der zur Verbrennung dienenden Luft
per Secunde durchströmt, würde seyn:
Volumen/(3600 × Querschnitt) = Kub. Met. 5,555023/(3600 .
0,00518) = 0,29789 Meter.
Die bei meinen Versuchen angewandten Brennstoff-Volume waren:
0,062 Met. Schichthöhe × mittlerer Querschnitt
des Herdes 0,0241047 Quad. Met.
=
0,0014967 Kub. Met.
0,124 Met. Schichthöhe × mittlerer Querschnitt
des Herdes 0,032655 Quad. Met.
=
0,0040494 Kub. Met.
0,186 Met. Schichthöhe × mittlerer Querschnitt
des Herdes 0,04246 Quad. Met.
=
0,0078975 Kub. Met.
Ferner hatten per 1 Kub. Met. Brennstoffstücke die
von
35mm Durchmesser
=
90 Quad. Met.
Contactfläche
30 „
=
105
„
„
20 „
=
157
„
„
daher waren die Contactflächen der
Brennstoffstücke
von 35mm
30mm
20mm
für„„
die„„
Schichthöhe„„
v.„„
0,062 = 0,1347 Q. M.0,124 =
0,36444 „0,186 =
0,71077 „
0,15715 Q.
M.0,42519 „0,82924 „
0,23498 Q.
M.0,63576 „1,2399 „
Dividirt man nun die gefundenen Geschwindigkeiten der durchströmenden Luft durch
diese Contactflächen, so erhält man einen Quotient welcher ausdrückt, wie groß die
Geschwindigkeit der Luft per 1 Quadratmeter Contactfläche gewesen ist. Das
Verhältniß, welches dieser Quotient bezeichnet, gestattet uns die relative
Vollkommenheit des Verbrennungsprocesses zu beurtheilen; ist jene Geschwindigkeit
eine zu große, so werden die Verbrennungsproducte unverbrannte Luft enthalten; ist
sie hingegen zu klein, so werden dieselben dem Herde brennbare Gase entführen.
Um die chemische Analyse der Gase auszuführen, habe ich mich Anfangs der Bunsen'schen Methode bedient, aber dieselbe bald wieder
aufgegeben, weil ohne eine sehr bedeutende Quecksilbermenge es nicht möglich gewesen
wäre die durchschnittliche Zusammensetzung der während wenigstens einer Stunde
abfließenden Gase zu erlangen. Ich habe daher die Gewichtsanalyse vorgezogen, welche
mir gestattete eine Stunde lang einen Gasstrom durch den Apparat zu führen.
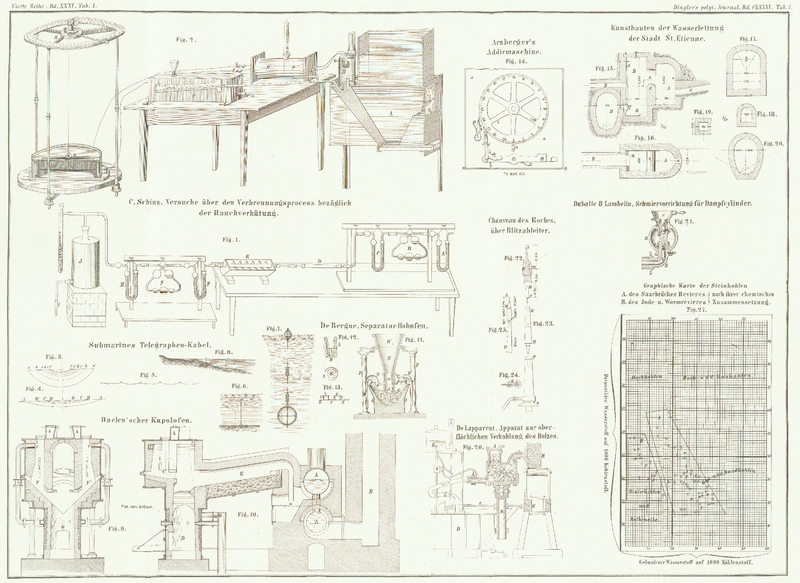
Der Apparat, dessen ich mich bediente, ist in Figur 1 abgebildet. A ist eine Chlorcalcium-Röhre, durch welche das
zu analysirende Gas hindurchströmen mußte, so wie es direct aus dem Ofen kam; B ist ein Kalilauge-Apparat, welcher die im Gase
enthaltene Kohlensäure absorbirte; C ist eine mit
Natronkalk gefüllte Röhre zur Absorption der aus B
entweichenden Wasserdämpfe oder unabsorbirten Kohlensäure. Die von Wasserdampf und
Kohlensäure befreiten Gase strichen nun durch die Phosphor-Röhre D von 35 Centimeter Länge, in welcher der in den Gasen
enthaltene freie Sauerstoff lebhaft absorbirt wurde; von da durchstrichen die Gase
die Kupferoxyd-Röhre E, in welcher vorhandenes
Kohlenoxyd-sowie Wasserstoffgas zu Kohlensäure und Wasser verbrannte.
Letzteres wurde in der folgenden Chlorcalcium-Röhre F absorbirt und die Kohlensäure in dem Kali-Apparate g, welchem noch eine Natronkalk-Röhre H folgte; der Stickstoff endlich wurde in der mit
Manometer versehenen Aspirator-Flasche J
angesammelt und das durch i abfließende Wasser in einem
Liter-Meßkolben sehr genau gemessen. Die Abflußöffnung i war so fein ausgezogen, daß eine Stunde verstrich bis aus der Flasche
J zwei Liter abgeflossen waren, so daß also per Secunde im Durchschnitt nur 0,5555.. Kubikcentimeter
Verbrennungsproducte durch den Apparat giengen. Nach Abfluß der 2 Liter Wasser wurde
dann noch etwa 1 Liter Stickstoffgas durch den ganzen Apparat gezogen, indem man vor
der Röhre A noch eine Phosphor-Röhre und eine mit
Kalihydrat gefüllte Röhre anbrachte und dann durch erstere atmosphärische Luft
einziehen ließ. Auf dieselbe Weise wurde der Apparat jedesmal vor Beginn der
analytischen Operation mit trockenem Stickstoffgase gefüllt.
Der Verbrennungsapparat, dessen ich mich bediente, ist ein kleiner Laboratorium-Ofen mit
Wasserbad und Destillirapparat; derselbe ist in Figur 2 abgebildet.
Der Rost, welcher in von außen beweglichen Stäben besteht, hatte nicht mehr als 13
Centimeter Seite und da er quadratisch ist, 0,0169 Quadratmeter Fläche, wovon etwa
ein Drittel der Luft Zutritt gestattete. Der Herd erweitert sich vom Roste aus nach
oben, so daß bei zunehmender Schichthöhe auch der mittlere Querschnitt zunimmt. Die
gebogene Röhre a mündet senkrecht in dem untersten
Theile des Kamines B und dient theils zum Messen des
Manometerstandes an diesem Orte, theils zur Verbindung mit dem analytischen
Apparate.
Das Manometer C ist wohl das empfindlichste, welches zu
solchen Versuchen zu Gebote steht; die Depression im Kamine B war jedoch so gering, daß dennoch die Manometer-Anzeigen kaum als
genau betrachtet werden können, denn die schief liegende Manometer-Röhre gab
für 1 Millimeter der Scala 0,144 Millimeter wirklichen Druck, so daß die Reibung
(Adhäsion) in der Röhre zuweilen größer war als die Kraft der Schwere.
Von bedeutendem Werthe sind die pyrometrischen Messungen der Temperatur im Kamine.
Die im Kamin eingesenkte Dille o enthält das
thermoelektrische Element, aus einem Kupfer- und Messingdrahte bestehend, mit
Quarzsand umgeben und isolirt; die Kühlvorrichtung p, p
und das Torsions-Rheometer S, S sind dieselben,
welche ich in meinen Abhandlungen über thermoelektrische Pyrometrie in diesem
Journale Bd. CLXXVII S. 85 und Bd. CLXXIX S. 436 beschrieben habe.
Die Versuche wurden jedesmal 7 bis 8 Stunden lang fortgesetzt, von welcher Zeit
einige Stunden dazu verwendet wurden, den Herd in den normalen Zustand zu versetzen
und dem Kamine eine constante Temperatur zu ertheilen, d.h. man feuerte so lang bis
das Pyrometer eine constante Temperatur angab, wornach die Beobachtungen während 5
Stunden fortgesetzt wurden.
Obgleich die Brennstoffstücke alle von annähernd gleicher Größe in den Herd gebracht
wurden, konnten sie in demselben doch nicht in dieser gleichförmigen Dimension
verbleiben, denn durch die Verbrennung wird ja ihr ursprüngliches Volumen auf Null
reducirt; dieser Umstand kommt aber nicht in Betracht, denn die Volumverminderung
des Brennstoffes ist bei allen Versuchen der Schichthöhe und der Größe der Stücke
proportional; nur ist die Vorsicht unerläßlich, den Herd in den normalen Zustand zu
bringen, bevor man mit den Beobachtungen beginnt.
Um beständig ein gleiches Volumen von Brennstoffstücken in dem Herde zu haben, wurden
in denselben rectanguläre eiserne Rahmen in 62, 124 und 186 Millimeter Entfernung über dem Roste
eingelegt; da die Wände des Herdes ansteigend sind, so konnten jene Rahmen aus ihrer
Lage nicht verrückt werden und dienten daher zur genauen Einhaltung der Schichthöhe.
Es wurden jedesmal 200 Gramme Brennstoffstücke abgewogen, deren Consum man bei der
stets nach je 15 Minuten vorgenommenen Beobachtung notirte. Je nach dem Consum mußte
der Herd nach 15 Minuten einmal oder auch zweimal ausgeebnet werden.
Wenn der Brennstoff aus Kohks bestand, waren Consum und Temperatur im Kamine während
der ganzen Versuchszeit ziemlich gleichförmig, bei den niedrigen Schichten sogar
ganz gleichförmig, bei den höheren hingegen etwas weniger, weil die unorganischen
Verbrennungsrückstände nicht eben so leicht durch bloßes Kämmen der Roststäbe
entfernt werden konnten.
Als aber Anthracit statt Kohks zu den Versuchen verwendet wurde, war es namentlich
bei höheren Schichten schwer eine Gleichförmigkeit der Temperatur und des Consums zu
erhalten. Noch weniger gelang es mit Steinkohlen, auch nur während einiger Stunden,
selbst bei bloß 62mm hoher Schicht, Regelmäßigkeit
zu erhalten. Um derartige Versuche mit Steinkohlen vornehmen zu können, müßte man
einen viel größeren Herd anwenden und einen Kamin mit Register benutzen, um den Zug
nach Bedürfniß reguliren zu können. Leider stand mir kein solcher Kamin zu Gebot;
die Kaminwirkung war bei meinen Versuchen ganz von dem Herde abhängig, was übrigens,
so weit sich diese Versuche erstreckten und für den beabsichtigten Zweck derselben
keine besonderen Nachtheile verursachte.
Wir gehen nun zu den einzelnen Versuchen und zu deren Berechnung über.
Versuch I. – Kohks von 35mm Durchmesser; stündlicher Consum 0,6 Kilogr.
Enthaltend Kil. 0,519 C und Kil. 0,012 HO = 0,4838 Kub. Met. C.
Die Analyse der Verbrennungsproducte gab:
Volumprocente
N
77,54
O
12,79
CO²
7,77
HO
1,90
––––––
100,00
In 7,77 CO² sind enthalten 3,885 Vol. C; somit geben die Verbrennungsproducte,
nach dem Verhältnisse 3,885: 0,4838 berechnet:
Kub. Met.
9,6559 N
=
9,6559 N
„
1,5927 O
=
1,5927 O
„
0,96759 CO²
=
0,96759 O
„
0,23660 HO
=
––––––––
––––––––
Kub. Met.
12,45279
Kub. Met.
12,21619
Verbrennungs-producte.
atmosphärischeLuft von 0°.
Volumen der atmosphärischen Luft per Secunde = Kub. Met.
0,00339.
Die Contactfläche der Kohkstücke bei 62mm
Schichthöhe ist (s. o.) = 0,1347 Quadratmeter.
Mittlerer Querschnitt des Herdes = 0,0241047 Q. M. × Querschnitt per 1 Q. M. = 0,2146 Q. M., daher der Querschnitt des
freien Raumes zwischen den Kohksstücken = 0,0051725 Quadratmeter.
Die Geschwindigkeit der Luft in der Kohksschicht ist folglich =
Volumen der Luft/Querschnitt zwischen den Kohks =
0,00339/0,0051725 = v = 0,6554 Met.
und daher die Geschwindigkeit der Luft per 1 Quadratmeter Contactfläche = 0,6554/0,1347 = 4,865 Meter.
Versuch II. – Kohks von 35mm Durchmesser. Stündlicher Consum 1,0 Kilogr.
Enthaltend Kilogr. 0,865 C und Kil. 0,020 HO = 0,80637 Kub. Met. C.
Die Analyse der Verbrennungsproducte gab:
Volumprocente
N
77,93
O
7,38
CO²
13,29
=
6,645 Vol. C
HO
1,40
Daher enthalten die Verbrennungsproducte:
Kub. Met.
9,4568 N
=
9,4568 N
0,89556 O
=
0,89556 O
1,61270 CO²
=
1,61270 O
0,16989 HO
––––––––
––––––––––
Kub. Met.
12,13495
Kub. Met.
11,96506
Verbrennungs-producte.
atmosphärischeLuft von 0°.
Volumen der atmosphärischen Luft per Secunde = Kub. Met. 0,003324.
Die Contactfläche der Kohksstücke bei 124mm
Schichthöhe ist = 0,36444 Quadratmeter.
Mittlerer Querschnitt des Herdes = 0,032655 Q. M. × 0,2146 = Querschnitt des
freien Raumes zwischen den Kohks = 0,007008 Quadratmeter.
Die Geschwindigkeit der Luft in der Kohksschicht ist daher =
Volumen der Luft/Querschnitt zwischen den Kohks =
0,003324/0,007008 = v = 0,4744 Met.
und folglich die Geschwindigkeit der Luft per 1 Quadratm. Contactfläche =
0,4744/0,36444 = 1,302 Meter.
Versuch III. – Kohks von 35mm Durchmesser. Stündlicher Consum 1,2 Kil.
Enthaltend Kil. 1,038 C und Kil. 0,024 HO = 0,96764 Kub. Met. C.
Die Analyse der Verbrennungsproducte gab:
Volumprocente
N
79,04
CO²
20,96
=
10,48 Vol. C,
daher enthalten die Verbrennungsproducte:
Kub. Met.
7,2978 N
=
7,2978 N
1,9353 CO²
=
1,9353 O
–––––
–––––––
Kub. Met.
9,2331
Kub. Met.
9,2331
Verbrennungs-producte.
atmosphärischeLuft von 0°.
Volumen der atmosphärischen Luft per Secunde = Kub. Met. 0,002565.
Die Contactfläche der Kohksstücke bei 186mm
Schichthöhe ist = 0,71077 Quadratmeter.
Mittlerer Querschnitt des Herdes = 0,04246 × 0,2146 = Querschnitt des Raumes
zwischen den Kohks = 0,009112 Quadratmeter.
Die Geschwindigkeit der Luft in der Kohksschicht ist daher =
Volumen der Luft/Querschnitt zwischen den Kohks =
0,002565/0,009112 = v = 0,2815 Meter
und folglich die Geschwindigkeit der Luft per 1 Quadratm. ContactflächeCondactfläche =
0,2815/0,71077 = 0,39605 Meter.
Versuch IV. – Kohks von 30mm Durchmesser. Stündlicher Consum 0,6 Kil.
Enthaltend Kil. 0,519 C und 0,012 HO = 0,4838 Kub. M. C.
Die Analyse der Verbrennungsproducte gab:
Volumprocente
N
77,620
O
9,584
CO²
11,000
=
5,500 Vol. C
HO
1,796
–––––––
100,000
Daher enthalten die Verbrennungsproducte:
Kub. Met.
6,8277 N
=
6,8277 N
0,84303 O
=
0,84303 O
0,96793 CO²
=
0,96793 O
0,15798 HO
––––––––
–––––––––
Kub. Met.
8,79664
Kub. Met.
8,63866
Verbrennungs-producte.
atmosphärischeLuft von 0°.
Volumen der atmosphärischen Luft per Secunde = Kub. Met.
0,0023996.
Die Contactfläche der Kohksstücke bei 62mm
Schichthöhe ist = 0,15715 Quadratmeter.
Mittlerer Querschnitt des Herdes = 0,0241047 × 0,2146 = Querschnitt des Raumes
zwischen den Kohks = 0,0051725 Quadratmeter.
Die Geschwindigkeit der Luft in der Kohksschicht ist daher =
Volumen der Luft/Querschnitt zwischen den Kohks =
0,0023996/0,0051725 = v = 0,46391 Meter,
und folglich die Geschwindigkeit der Luft per 1 Quadratm. Contactfläche =
0,46391/0,15715 = 2,9520 Meter.
Versuch V. – Kohks von 30mm Durchmesser. Stündlicher Consum 0,8 Kilogr.
Enthaltend Kilogr. 0,692 C und Kil. 0,016 HO = 0,6451 Kub. Met. C.
Die Analyse der Verbrennungsproducte gab:
Volumprocente
N
78,427
O
5,233
CO²
15,562
=
7,781 Vol. C
HO
0,737
Daher enthalten die Verbrennungsproducte:
Kub. Met.
6,5058 N
=
6,5058 N
0,43385 O
1,29020 CO²
=
0,43385 O
0,061103 HO
=
1,29020 O
–––––––
–––––––––
Kub. Met.
8,290953
Kub. Met.
8,22985
Verbrennungs-producte.
atmosphärischeLuft von 0°.
Volumen der atmosphärischen Luft per Secunde = Kub. Met. 0,002286.
Die Contactfläche der Kohksstücke bei 124mm
Schichthöhe ist = 0,42519 Quadratmeter.
Mittlerer Querschnitt des Herdes = 0,032655 × 0,2146 = Querschnitt des freien
Raumes zwischen den Kohks = 0,007008 Quadratmeter.
Die Geschwindigkeit der Luft in der Kohksschicht ist daher =
Volumen der Luft/Querschnitt zwischen den Kohks =
0,002286/0,007008 = v = 0,3262 Meter,
und folglich die Geschwindigkeit der Luft per 1 Quadratm. Contactfläche =
0,3262/0,42519 = 0,7672 Meter.
Versuch VI. – Kohks von 30mm Durchmesser. Stündlicher Consum 0,8 Kilogr. Enthaltend Kil.
0,692 C und Kil. 0,016 HO =
0,6451 Kub. Met. C.
Die Analyse der Verbrennungsproducte gab:
Volumprocente
N
78,336
O
1,066
CO²
19,446
=
9,723 Vol. C.
CO
0,518
=
0,259
„ „
–––––
9,982 Vol. C.
H
0,148
HO
0,486
–––––––
100,000
Daher enthalten die Verbrennungsproducte:
Kub. Met.
5,0626 N
=
5,0626 N
0,068891 O
=
0,068891 O
1,256700 CO²
=
1,256700 O
0,033477 CO
=
0,016738 O
0,0095647 H
0,0314080 HO
––––––––
––––––––––
Kub. Met.
6,4626407
Kub. Met.
6,404929
Verbrennungs-producte.
atmosphärischeLuft von 0°.
Volumen der atmosphärischen Luft per Secunde = Kub. Met.
0,0017791.
Die Contactfläche der Kohksstücke bei 186mm
Schichthöhe ist = 0,82924 Quadratmeter.
Mittlerer Querschnitt des Herdes = 0,04246 × 0,2146 = Querschnitt des freien
Raumes zwischen den Kohks = 0,009112 Quadratmet.
Die Geschwindigkeit der Luft in der Kohksschicht ist daher =
Volumen der Luft/Querschnitt zwischen den Kohks =
0,0017791/0,009112 = v = 0,19525 Meter
und folglich die Geschwindigkeit der Luft per 1 Quadratmet. Contactfläche =
0,19525/0,82924 = 0,23546 Meter.
Versuch VII. – Kohks von 20mm Durchmesser. Stündlicher Consum 0,6 Kilogr.
Enthaltend Kil. 0,519 C und 0,012 HO = 0,4838 Kub. Met. C.
Die Analyse der Verbrennungsproducte gab:
Volumprocente
N
77,269
O
9,208
CO²
11,282
=
5,641 Vol. C.
HO
2,241
–––––––
100,000
Daher enthalten die Verbrennungsproducte:
Kub. Met.
6,6269 N
=
6,6269 N
0,78972 O
=
0,78972 O
0,96760 CO²
=
0,96760 O
0,19220 HO
––––––
–––––––––
Kub. Met.
8,57642
Kub. Met.
8,38422
Verbrennungs-producte.
atmosphärischeLuft von 0°.
Volumen der atmosphärischen Luft per Secunde = Kub. Met.
0,002329.
Die Contactfläche der Kohksstücke bei 62mm
Schichthöhe ist = 0,23498 Quadratmeter.
Mittlerer Querschnitt des Herdes = 0,0241047 × 0,2146 = Querschnitt des freien
Raumes zwischen den Kohks = 0,0051725 Quadratmeter.
Die Geschwindigkeit der Luft in der Kohksschicht ist daher =
Volumen der Luft/Querschnitt zwischen den Kohks =
0,002329/0,0051725 = v = 0,45027 Meter
und folglich die Geschwindigkeit der Luft per 1 Quadratm. Contactfläche =
0,45027/0,23498 = 1,9162 Meter.
Versuch VIII. – Kohks von 20mm Durchmesser. Stündlicher Consum 0,8 Kilogr.
Enthaltend Kil. 0,692 C und 0,016 HO = 0,6451 Kub. Met. C.
Die Analyse der Verbrennungsproducte gab:
Volumprocente
N
76,196
O
0,620
CO²
18,155
=
9,0775 Vol. C
CO
1,431
=
0,7155
„ „
–––––
9,7930 Vol. C
H
2,863
HO
0,735
––––––
100,000
Daher enthalten die Verbrennungsproducte:
Kub. Met.
3,987 N
=
3,987
N
0,040842 O
=
0,040842 O
1,195900 CO²
=
1,195900 O
0,094265 CO
=
0,0471325 O
0,188600 H
0,042416 HO
–––––––
–––––––––––
Kub. Met.
5,555023
Kub. Met.
5,2708745
Verbrennungs-producte.
atmosphärischeLuft von 0°.
Volumen der atmosphärischen Luft per Secunde = Kub. Met.
0,0014641.
Die Contactfläche der Kohsstücke bei 124mm
Schichthöhe ist = 0,63576 Quadratmeter.
Mittlerer Querschnitt des Herdes = 0,032655 × 0,2146 = Querschnitt des freien
Raumes zwischen den Kohks = 0,007008 Quadratmeter.
Die Geschwindigkeit der Luft in der Kohksschicht ist daher =
Volumen der Luft/Querschnitt zwischen den Kohks =
0,0014641/0,007008 = v = 0,20892 Meter
und folglich die Geschwindigkeit der Luft per 1 Quadrm. Contactfläche =
0,20892/0,63576 = 0,3286 Meter.
Versuch IX. – Kohks von 20mm Durchmesser. Stündlicher Consum 0,8 Kilogr.
Enthaltend Kilogr. 0,692 C und 0,016 HO = 0,6451 Kub. Met. C.
Die Analyse der Verbrennungsproducte gab:
Volumprocente
N
69,876
O
0,439
CO²
6,499
=
3,2995 Vol. C
CO
23,186
=
11,5930
„ „
––––––
14,8925 Vol. C
Daher enthalten die Verbrennungsproducte:
Kub. Met.
3,03700 N
=
3,03700 N
0,01908 O
=
0,01908 O
0,28246 CO²
=
0,28246 O
1,00770 CO
=
0,50385 O
––––––
–––––––––
Kub. Met.
4,34624
Kub. Met.
3,84239
Verbrennungs-producte.
atmosphärischeLuft von 0°.
Volumen der atmosphärischen Luft per Secunde = Kub. Met.
0,0010673.
Die Contactfläche der Kohksstücke bei 186mm
Schichthöhe ist = 1,2399 Quadratmeter.
Mittlerer Querschnitt des Herdes = 0,04246 × 0,2146 = Querschnitt des freien
Raumes zwischen den Kohks = 0,009112 Quadratmet.
Die Geschwindigkeit der Luft in der Kohksschicht ist daher:
Luftvolumen/Querschnitt zwischen den Kohks = 0,0010673/0,009112 =
v = 0,11713 Meter
und folglich die Geschwindigkeit der Luft per 1 Quadratm. Contactfläche =
0,11713/1,2399 = 0,09447 Meter.
Stellen wir nun diese Resultate übersichtlich zusammen, so enthielten die
Verbrennungsproducte bei den Geschwindigkeiten = v per 1
Quadratmeter Contactfläche:
I
II
III
IV
V
v = Meter
4,865;
1,302;
0,396;
2,952;
0,767;
Luftüberschuß, Proc.
61,0
35,2
0
45,7
24,9
brennbare Gase, Proc.
COH
00
00
00
00
00
VI
VII
VIII
IX
v = Meter
0,235;
1,916;
0,328;
0,094
Luftüberschuß, Proc.
5,1
43,9
2,9
2,2
brennbare Gase, Proc.
COH
0,5180,184
00
1,4312,863
23,1860
oder in der Folge-Ordnung der Geschwindigkeiten:
I
IV
VII
II
V
v = Meter
4,865;
2,952;
1,916;
1,302;
0,767;
Luftüberschuß, Proc.
61,0
45,7
43,9
35,2
24,9
brennbare Gase, Proc.
COH
00
00
00
00
00
VIII
III
VI
IX
v = Meter
0,328;
0,396;
0,235;
0,094
Luftüberschuß, Proc.
2,9
0
5,1
2,2
brennbare Gase, Proc.
COH
1,4312,863
00
0,5180,184
23,1860
Somit zeigt sich zwar eine genaue Uebereinstimmung nicht, aber eine solche, welche
die kühnsten Erwartungen übertrifft; denn bei einer bloß annähernden Berechnung der
Contactflächen, wie sie durch die Natur der Sache ermöglicht war, hätte auch eine
noch geringere Uebereinstimmung vollkommen befriedigen können.
Diese Versuche thun daher dar:
1) daß die Vollkommenheit der Verbrennung abhängt von der
Contactfläche im Verhältnisse zu der Geschwindigkeit der zuströmenden
Luft;
2) daß bei der Geschwindigkeit 0,39 Meter die Verbrennung von
Kohks eine vollkommene werden kann;
3) daß bei weiter abnehmender Geschwindigkeit bereits brennbare
Gase in den Verbrennungsproducten auftreten;
4) daß bei der Geschwindigkeit 0,09 Meter beinahe aller
Kohlenstoff als Kohlenoxyd auftritt.
Unsere Berechnung der Contactfläche betrifft nur die Oberfläche der Stücke; in
Wirklichkeit ist sie viel größer, da die Kohks ein sehr poröser Körper sind; die
Wandungen dieser Poren müssen natürlich die Contactfläche um ein Mehrfaches
vergrößern.
Noch viel poröser sind Holzkohlen, und es wird daher die Geschwindigkeit der durch
eine Holzkohlenschicht streichenden Luft bei gleicher Oberfläche der Stücke eine
viel größere seyn dürfen. Schon die tägliche Erfahrung lehrt, daß Holzkohlen sehr
leicht Kohlenoxydgas erzeugen, selbst in Verbrennungsapparaten in denen kein Mangel
an Zug ist.
Demnach wird für jeden Brennstoff ein besonderes Gesetz gelten, d.h. die
erforderlichen Geschwindigkeiten der Luft werden durch die Natur der Brennstoffe
modificirt.
(Der Schluß folgt im nächsten Heft.)
Tafeln